Etiquetas
#pandemia #COVID-19 #triaje #toma de decisiones #comorbilidades #cuidados paliativos #Dolor crónico #Neurocirugía #Síndrome de Fracaso de Cirugía Espinal Lumbar #anestesia espinal unilateral #dosis mínima #lateralización #cirugía traumatológica ambulatoria #nervio pudendo #neuralgia #radiofrecuencia pulsada; ultrasonido. #dolor #dolor neuropatico #topiramato #dolor agudo postquirúrgico #dolor incisiona #anestesia #niños #dolor agudo #dolor quirurgico #modelos y teorias #enfermeria #noticias #Investigación en Servicios de Salud #Rehabilitación #ansiedad #emociones #miedo #tristeza #Parche #Buprenorfina #Fentanilo #problemas sociales #síndrome pediátrico inflamatorio multisistémico #fibromialgia #narrativas #experiencia #Afrontamiento #estados emocionales #dolor de espalda #Cuidado paliativo #opioidesRevista El Dolor 55 | Julio 2010 - Año 20 | Originales
Guía para Definición y Manejo del Dolor Neuropático Localizado (DNL): Consenso Chileno
Fernández, Rodrigo (1), Ahumada, Marisol (2), Muñoz, Ronny (3), Urra, Ximena (4), Yáñez, M. Verónica (5), Velasco, Maritza (6), Aguayo, Carlos (7), Bilbeny, Norberto (8), Correa, Gerardo (9), Flores, Carlos (10), Rabah, Edward (11), Jaque, Juanita (12), Sánchez, Patricia (13), Ortiz, Luis (14), Orellana, Matías (15), Pakuts, Andrés (16), Muñoz, Eduardo (17), Ritter, Paola (18), Orellana, M.E. (19), Mora, Ximena (20).
(1) Presidente ACHED, Unidad de Dolor y Cuidados Paliativos, Hospital del Salvador, Santiago, Chile
(2) Instituto Nacional del Cáncer, Santiago, Chile
(3) Clínica INDISA, Santiago, Chile
(4) Unidad de Dolor y Cuidados Paliativos, Hospital del Salvador, Santiago, Chile
(5) Instituto de Rehabilitación Infantil Teletón y COANIQUEM, Santiago, Chile
(6) Unidad de Dolor Hospital Militar, Santiago, Chile
(7) Unidad de Dolor FUSAT, Rancagua, Chile
(8) Unidad de Dolor Hospital Militar, Santiago, Chile
(9) Unidad de Rehabilitación y Neurofisiología Clínica
Hospital del Trabajador, Santiago, Chile
(10) Hospital FACH y Mutual de Seguridad, Santiago, Chile
(11) Unidad de Anestesia y Alivio de Dolor Hospital San Pablo, Coquimbo, Chile
(12) Unidad de Dolor Hospital Clínico Universidad de Chile, Santiago, Chile
(13) Unidad de Dolor Hospital Las Higueras, Talcahuano,
Chile
(14) Unidad de Dolor Hospital Las Higueras, Talcahuano,
Chile
(15) Instituto de Rehabilitación Infantil Teletón y COANIQUEM, Santiago, Chile
(16) , Centro Oasis, Clínica Elqui y Hospital San Pablo de Coquimbo, Chile
(17) Unidad de Dolor CHSJ, Santiago, Chile
(18) Unidad de Dolor y Cuidados Paliativos, Hospital del Salvador, Santiago, Chile
(19) Unidad de Dolor Hospital del Salvador, Santiago,
Chile
(20) Clínica Alemana, Santiago, Chile
Resumen
En los últimos años, diversas Guías para el Manejo del Dolor Neuropático (DN) se han elaborado por grupos de expertos en Dolor. La Asociación Chilena para el Estudio del Dolor (ACHED), representada por diversos especialistas, se reunió los días 5 y 6 de agosto para elaborar la “Guía para Definición y Manejo del Dolor Neuropático Localizado (DNL): Consenso Chileno”.
Utilizando el Método Delphi, se establecieron consensos con respecto a la entidad Dolor Neuropático Localizado (DNL), tanto en su Definición, Diagnóstico, Manejo Farmacológico y No Farmacológico, constituyendo de este modo, cuatro (4) grupos de trabajo; se establecieron asimismo comisiones para Dolor Pediátrico y Procedimientos Intervencionistas.
Los principales resultados permiten contar con una definición clara de DNL, innovaciones en su diagnóstico, algoritmos sencillos para su manejo y recomendaciones no farmacológicas de importancia.
Esta Guía para la Definición, Diagnóstico y Manejo del DNL será una herramienta de mucha utilidad en la práctica clínica, especialmente para los médicos generales y para la conformación de equipos multidisciplinarios para la mejor atención de los pacientes de DNL. El Consenso, luego de revisar evidencias y por la experiencia clínica de los expertos, recomiendan las terapias tópicas como las más indicadas en tratamiento del DNL.
Palabras Clave: Dolor Neuropático, Dolor Neuropático Localizado, Consenso, Dolor.
Abstract
In recent years, several Guidelines for the Management of Neuropathic Pain (NP) have been developed by groups that specialize in pain. The Chilean Association for the Study of Pain (ACHED), represented by different specialists, met on the 5th and 6th of August to develop the Guidelines for Definition and Management of Localized Neuropathic Pain (LNP): Chilean Consensus”.
Using the Delphi method, a series of consensus have been established regarding the Localized Neuropathic Pain (LNP) entity, both in its definition, diagnosis, pharmacological and non- pharmacological management, thus constituting four (4) work groups; committees were also established for pediatric pain and interventional procedures.
The main results allow us to have a clear definition of LPN, innovations in its diagnosis, simple algorithms for its management and important non-pharmacological recommendations.
The Guidelines for Definition and Management of the LNP will be a very useful tool in clinical practice, especially for general practitioners and for the formation of multidisciplinary teams to improve healthcare for LNP patients. The Consensus, after reviewing evidence and clinical experience, recommends topical therapies as the most appropriate treatment in LPN.
Keywords: Neuropathic pain, localized neuropathic pain, Consensus, Pain.
Introducción
En América Latina se estima que el dolor neuropático (DN) afecta al 2% de la población (1) y que 15 de cada 100 pacientes que acuden a consulta médica, por causa del dolor, sufren de dolor neuropático.
Los cuadros de DN más frecuentes en la consulta médica en nuestra región, y se infiere como referencia para Chile, son: lumbalgia con componente neuropático (34,2%); neuropatía diabética (30,4%); neuralgia post herpética (8,7%) y DN como secuela postquirúrgica (6,1%) (2).
A pesar de la prevalencia del DN en las poblaciones latinoamericanas, hay escasas pautas sobre su manejo. Más escasas aún son las guías sobre diagnóstico diferencial, localización y evaluación y algoritmos de manejo sobre el dolor neuropático localizado (DNL), objeto de nuestro trabajo.
El Grupo de Consenso hizo una búsqueda bibliográfica e identificó varios publicaciones realizadas en los últimos años en Estados Unidos, Europa y en países latinoamericanos, entre ellos:
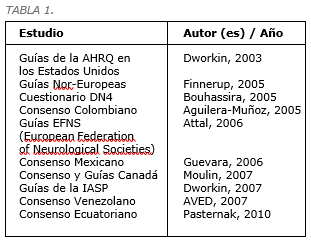
Esta fue la documentación de base que fuera revisada por el Grupo de Consenso para proceder luego a intercambiar sus experiencias clínicas en Chile y así diseñar una guía práctica de manejo del DNL en el país.
De la revisión, observamos que en los últimos cinco años se han publicado algunas guías para el diagnóstico y el manejo del dolor neuropático, la mayoría de ellas en inglés y procedentes de países que cuentan con sistemas de salud desarrollados y con amplia disponibilidad de alternativas terapéuticas (3, 4, 5,
6, 7).
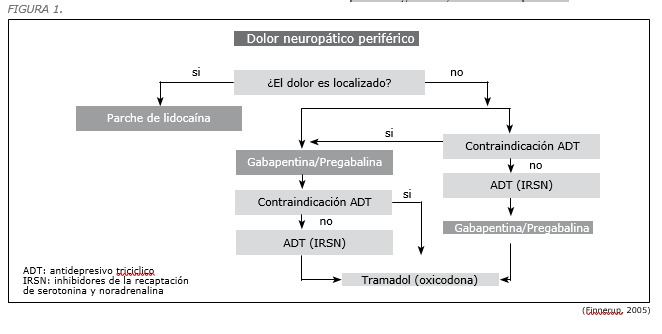
No obstante, en nuestro proceso de revisión de guías de manejo del dolor, se identificaron escasas referencias sobre el diagnóstico y alivio del dolor neuropático localizado (DNL). Así por ejemplo, sólo encontramos un algoritmo (5) que motiva al médico a diferenciar el manejo si se trata de un fenómeno doloroso localizado o difuso (Figura 1).
Adicionalmente, las escasas recomendaciones generales sobre el DNL no están acordes con la realidad del ejercicio médico, ni con la disponibilidad de recursos diagnósticos o terapéuticos en América Latina.
Más recientemente, fueron publicadas una guía y recomendaciones para el tratamiento del dolor neuropático auspiciada por la IASP, realizada por científicos y expertos clínicos de los EE.UU. y Europa (3), y varios consensos en DNL de expertos latinoamericanos auspiciados por FEDELAT (1, 8, 9, 10).
Dado que estas guías citadas no necesariamente reflejan las condiciones de la práctica clínica en Chile, ACHED convocó a un grupo multidisciplinario de expertos nacionales con el objetivo de desarrollar y adaptar recomendaciones en forma de pautas de referencia para el diagnóstico y manejo del dolor neuropático localizado (DNL).
ACHED entrega estas «Guías para Definición y Manejo del Dolor Neuropático Localizado (DNL): Consenso Chileno» para orientar y motivar a los médicos, especialmente a los médicos generales, que en su práctica diaria deben tratar pacientes con dolor neuropático localizado, careciendo hasta ahora de pautas para su diagnóstico y tratamiento específico.
Materiales y Métodos
El grupo de trabajo para el desarrollo de este Consenso Chileno estuvo conformado por 20 especialistas en: medicina interna, medicina del dolor, neurología clínica y neurofisiología, anestesiología, ortopedia y traumatología, fisiatría, farmacología, psicología y enfermería.
Se conformaron cuatro grupos de trabajo, con base en las fortalezas individuales y la experiencia clínica de cada participante para tratar tópicos específicos propuestos por el comité organizador:
• Definición de DNL. Categorización de cuadros más frecuentemente asociados con DNL.
• Elementos para el diagnóstico de DNL.
• Pautas del manejo farmacológico.
• Pautas de manejo no farmacológico.
• Algoritmos de diagnóstico, evaluación, tratamiento y seguimiento del DNL.
Como documentos adicionales, el Consenso decidió incluir dos apartados especiales, uno sobre dolor neuropático pediátrico y otro sobre procedimientos intervencionistas, que enriquecen esta guía de DNL.
Para la fundamentación del trabajo, cada grupo hizo una revisión de ensayos clínicos, publicaciones y guías de manejo internacionales recientes, y realizó una exposición y análisis de sus propias experiencias clínicas, seleccionando tópicos pertinentes. Se establecieron prioridades, iniciándose la discusión en cada grupo para elaborar un documento con las conclusiones, las que fueron presentadas en sesiones plenarias realizadas entre el 5 y 6 de agosto de 2011 en Santiago de Chile.
Se usó la metodología Delphi para llegar a recomendaciones consensuadas, a partir de las presentaciones de cada grupo y el debate en el plenario, alcanzando finalmente un consenso fiable y sin sesgos. El método presenta tres características fundamentales: anonimato en la votación, iteración y retroalimentación controlada del grupo (11). Se consideró que había consenso cuando el 80% de los participantes llegaba a un acuerdo. Si la votación del tema en consideración era <80%, se incorporaban las nuevas opiniones y comentarios hasta lograr que el puntaje aprobatorio fuese >80%.
1. Definición de Dolor Neuropático Localizado (DNL) Como un punto de referencia inicial para estas guías, el Grupo de Interés Especial sobre Dolor Neuropático [del inglés “Special Interest Group on Neuropathic Pain (NeuPSIG)”] de la IASP, propuso a finales del 2007 una nueva definición de DN como “el dolor que se origina como consecuencia directa de una lesión o enfermedad que afecta al sistema somatosensorial” (cita). En esta nueva definición, el término “enfermedad” se refiere a procesos patológicos específicos, como p.e. inflamación, enfermedades autoinmunes, mientras que la palabra “lesión”, se refiere a un daño macro o microscópicamente identificable (16).
Así, el dolor neuropático es un síndrome doloroso crónico, en el cual el mecanismo generador del dolor se halla en cualquier
sitio a lo largo del recorrido de las vías nociceptivas, sin estimular inicialmente a los nociceptores, a diferencia de lo que sucede en el dolor nociceptivo o fisiológico y, por tanto, el DN es una enfermedad neurológica (17).
Para avanzar hacia un consenso en la definición, epidemiología específica y diferencial del DNL, el grupo de Consenso Chileno revisó las principales referencias internacionales existentes que han elaborado definiciones sobre DNL. Sin embargo, se hacen necesarias más precisiones sobre sus características para ayudar a un adecuado diagnóstico y, desde luego, a una evaluación y tratamiento del DNL en la realidad de la práctica clínica en Chile y en los países de América Latina.
1.1 Conceptualización DNL
En general, los consensos revisados definen DNL como un tipo de neuropatía periférica que afecta a una pequeña área corporal. Hablan, en general, de una neuropatía determinadamente superficial, en que hay una percepción alterada de la sensibilidad cutánea con áreas de dolor circunscritas y consistentes que afectan al sistema somatosensorial periférico.
En cuanto al nervio comprometido, en el DNL es indiferente si el dolor se origina en la placa terminal o más arriba. La definición no apunta a dónde se inicia el dolor, sino que prioriza el lugar donde se produce la expresión corporal del dolor.
Habiendo analizado aspectos como el origen, extensión, intensidad y características del dolor neuropático, confrontando los criterios del grupo y la diferenciación europea (5,7), la definición de DNL acordada por el grupo y consensuada por el plenario de expertos chilenos es:
1.2. Esquema Clínico Sintomático de DNL
Teniendo en cuenta la sintomatología clínica descrita para el dolor neuropático (18), llegamos a la conclusión que el DNL es determinantemente superficial, que hay una percepción alterada de la sensibilidad cutánea, que puede manifestarse como síntomas positivos, que son espontáneos o evocados, y/o negativos (Tabla 2), pudiendo tener un curso agudo o crónico y que el paciente puede presentar en forma simultánea más de un DNL.
1.3. Epidemiología del DNL
Dado que el dolor neuropático (DN) es una enfermedad heterogénea con una sintomatología diversa (Tabla 3), las controversias existentes respecto a su definición y clasificación dificultan conocer su epidemiología.
Aunque la carga de dolor neuropático es bien reconocida, la epidemiología del dolor neuropático localizado no ha sido bien descrita.
.png)
En general se trata de una patología subdiagnosticada, por lo que una conceptualización y una definición, como la alcanzada en este Consenso Chileno, ayudará a un adecuado diagnóstico y a tener datos más precisos sobre su prevalencia.
Según los escasos estudios referenciales publicados en América Latina, la prevalencia del dolor neuropático es del 2% (10) y en Europa el 60% del dolor neuropático es localizado (5,7,19,20)
Algunas neuropatías han sido evaluadas ampliamente, como la neuropatía diabética dolorosa (PND) y la neuralgia postherpética (NPH). Muchos otros síndromes de dolor neuropático periférico y central han sido estudiados con menor frecuencia.
Aunque los datos son aún incompletos, esta revisión resume la incidencia y la información sobre la prevalencia de cuadros de dolor neuropático de alta frecuencia en poblaciones específicas (Tabla 4).
.png)
Esta prevalencia epidemiológica se suma al impacto psicológico y psicosocial del DNL, por ejemplo interferencia con la actividad general, afectación del estado de ánimo, de la movilidad, interferencia con el trabajo, las relaciones sociales, el sueño, las actividades lúdicas y la capacidad de disfrutar la vida, documentado en varios estudios (21).
Por la dificultad que puede significar para médicos generales diferenciar y definir cuáles dolores neuropáticos son localizados, el grupo de consenso recomienda aplicar una encuesta en Chile para medir tendencias.
Se propone aplicar una encuesta nacional para registrar en un lapso determinado y breve, cuántos pacientes consultan por dolor, de esos cuántos son por dolor neuropático y de ellos, cuántos corresponden a la categorización de DNL.
2. Elementos para el Diagnóstico de DNL
El grupo de Consenso recomienda llegar al diagnóstico diferenciado de DNL a través de 4 pasos clínicos (Tabla 5), que no necesariamente deben aplicarse como un todo, sino que en forma gradual para avanzar hacia un diagnóstico eventual de DNL definitivo, probable, posible o descartado.
Deben entenderse como elementos clínicos aquellos que nos ayudarán a hacer un buen diagnóstico de DNL. El médico clínico podrá hacer todos los pasos requeridos para el diagnóstico y podrá basarse fundamentalmente en la semiología clínica.
En el diagnóstico nos enfocamos en la parte clínica, porque exámenes complementarios se utilizan como instancia posterior si las anteriores no fueron concluyentes para hacer el diagnóstico de neuropatía.
2.1. Historia Clínica
La anamnesis debe aportar datos generales para la evaluación del paciente como: Conocer la historia clínica del paciente y sus antecedentes, signos relevantes de dolor, consignar las “banderas rojas” (por ejemplo, cáncer, infección reciente, inmunosupresión, TAC, pérdida de peso de causa no precisada), co-morbilidades o síntomas de dolor
que pueden estar relacionados con alguna enfermedad. Se debe hacer una evaluación de la intensidad del dolor con escala visual análoga (EVA) o escala numérica, consignando temporalidad y periodicidad.
2.2. Evaluación del DNL
De los 5 tests que hay en este momento para la detección de DN, el DN4 (6), cuestionario de 7 preguntas referidas al dolor y 3 elementos de examen físico, elaborado por el grupo “French Neuropathic Pain Control”, es una herramienta muy útil para la diferenciación de dolor neuropático y dolor nociceptivo. Está validado globalmente y tiene una sensibilidad de un 83% y una especificidad del 90%.
El grupo de consenso recomienda utilizar la forma DN4 interview (Figura 2), que es el DN4 abreviado, que considera sólo las 7 preguntas de la entrevista. Considerando que esta guía de consenso está desarrollada especialmente para la orientación de los médicos generales, el DN4 Interview es muy fácil de aplicar, pudiendo incluso ser realizado por la enfermera o autoadministrado por el paciente, pues ha sido adaptado para ello. Esta forma corta de evaluación del DN4 está validada y tiene una correlación significativa con el DN4 clínico original, con una sensibilidad 81,6% y una especificidad de 85,7% (20).
La alteración del estado de ánimo, del sueño y las relaciones sociales son manifestaciones psicológicas y psicosociales asociadas al DN (17). Por ello, el grupo de Consenso sugiere, como elemento coadyuvante al diagnóstico de DN, la aplicación complementaria del Cuestionario de Impacto Emocional (CIE-6), en escala EVA (0-10), con seis descriptores para evaluar la repercusión psicológica y en la esfera psicosocial del dolor neuropático (Figura 3).
El cuestionario CIE-6 es de sencilla y rápida aplicación y puede ser administrado por otros profesionales de la salud o autoadministrado por el paciente. Valora el sufrimiento humano a causa del dolor, en este caso aplicado a DNL, en los rangos leve, moderado y severo. Los primeros cuatro ítems dan cuenta del impacto emocional y los dos últimos de la esfera conductual; ambos están permeados por factores cognitivos, sensoriales y espirituales.
.png)
.png)
.png)
2.3. Examen Físico
En el examen físico hay que identificar los signos positivos y negativos de DNL (Tabla 6). Para darle mayor simplicidad, consideramos básicamente aquéllos signos positivos que permitan evocar el dolor. Los signos positivos mencionados se han validado y cuentan con una base científica.
Como estamos diagnosticando DNL, es importante la demarcación (23). En el examen físico se debe medir el área dolorosa según información del paciente y luego rechequear sin la visión de éste (Tabla 7). Se debe efectuar una medición de cuál es el tamaño que tiene esta área, considerando su máximo ancho y su máximo largo (Ver foto 1). Los hallazgos en el área dolorosa deberían ser comparados con el área contralateral en condiciones de dolor unilateral. En polineuropatía, una delineación próximo-distal es aconsejada (16).
2.4. Exámenes complementarios
La interpretación de las ayudas diagnósticas con exámenes complementarios no puede hacerse en ausencia de la historia y examen clínico. No existen estudios diagnósticos específicos para el DNL (24). Las pruebas a realizar son muchas y variadas, principalmente enfocadas a investigar la etiología y determinar parámetros de laboratorio (25).
El diagnóstico de DNL puede ser complementado por pruebas que evalúen neuropatía. En caso del DN periférico, se recomiendan los estudios neurofisiológicos (electromiografías, neuroconducción sensitiva y motora, y potenciales evocados somatosensoriales y laser) (26). Para el DN central se recomiendan los estudios de imágenes (ecografía, TC y RMI). Se recomienda además la realización de test sensitivo cuantitativo (QST) y biopsias de piel y nervio, en algunos casos seleccionados, como la sospecha de neuropatía periférica de fibra pequeña. Si los exámenes complementarios nos orientan a compresión o daño nervioso, con historia y examen clínico positivos, estamos frente a un DNL definitivo.
.png)
.png)
2.5. Algoritmo de Diagnóstico DNL
Se recomienda aplicar un algoritmo desarrollado en revisiones de referencia (Figura 4) y en los que se han aplicado criterios que parecieron importantes al Consenso para el diagnóstico de DNL, basado en una estrategia de dos pasos: detección y evaluación. Esta es una adaptación y son pasos para todo diagnóstico de DN, no sólo localizado.
Este algoritmo de DNL lleva a un sistema de graduación del diagnóstico con cuatro resultados eventuales, en función del grado de certeza propuesto por la IASP: DNL definitivo, probable, posible y dolor no neuropático.
Como una herramienta de ayuda, entregamos una tabla breve de interpretación del algoritmo para definición del diagnóstico (Tabla 8).
Hay que considerar que aunque el DN4 sea negativo, hay un 20% de probabilidad de presentar dolor neuropático probable al tener un examen físico y exámenes complementarios positivos y que debiera tratarse.
En el DNL se recomienda controlar la efectividad del tratamiento en controles sucesivos a los pacientes, reevaluando los siguientes elementos:
- Intensidad del dolor (50% o más de alivio del dolor).
- Área del dolor (50% o más de reducción de área dolorosa).
- Presencia/ausencia de alodinia.
.png)
.png)
.png)
3. Dolor Neuropático Pediátrico
Los pacientes pediátricos pueden tener dolor de característica neuropática, aunque este fenómeno está subdiagnosticado
– como es también en adultos- y no forma parte de la consideración habitual en la evaluación de los niños. Los niños pueden tener incapacidad para describir el dolor y esto ha llevado a los clínicos a concluir que el dolor es una experiencia diferente en niños y adultos.
Aunque se utilizan muchas pruebas para medir y valorar el dolor, ninguna suministra por si sola suficiente información acerca del dolor y de sus componentes para ser aplicada como medida convencional del dolor en los niños.
El dolor intenso o severo puede ser medido en niños menores o iguales de siete años, usando escalas de analogía visual (27). El dolor pediátrico es infravalorado y, frecuentemente, infratratado. Por un lado, hay dificultad para valorar el grado de dolor en niños debido a la incapacidad para expresarse o a la falta de comprensión que tienen para identificar este síntoma. Por otro lado, ciertos mitos culturales en relación al dolor pediátrico asumen que los niños no sienten dolor.
El control del dolor en los niños es un componente vital en la atención pediátrica. El manejo óptimo del dolor comienza con la valoración del dolor, que debe hacerse desde el triage, incluirse como una constante vital más y revaluarse en el curso de su estancia hospitalaria (29, 30).
A la hora de valorar el dolor en niños, debemos ser lo más objetivos posible. Hay varios factores a tener en cuenta, como son la edad del paciente, el desarrollo neurológico que es distinto en cada grupo de edad, las diferencias individuales en la percepción del dolor y las diferencias en la forma de expresar el dolor (31).
Existen varios métodos validados que tienen en cuenta estos factores, como son las escalas de valoración del dolor pediátrico. El estándar de referencia en la valoración del dolor es la utilización de escalas, como la analógica visual o escala de caras (Figuras 5 y 6). Cuando no es posible la valoración del dolor por parte del paciente, deben realizarse escalas conductuales junto con los datos de la historia y examen físico.
Los pacientes pediátricos pueden tener dolor de característica neuropática, aunque este fenómeno está subdiagnosticado
– como es también en adultos- y no forma parte de la consideración habitual en la evaluación de los niños (32).
El objetivo de manejo de dolor no sólo es su disminución parcial o total, sino además mejorar la funcionalidad del niño, permitir un adecuado desarrollo psicomotor y mejorar la calidad de vida del paciente y su familia (33).
Dentro de la consulta que se hace al paciente, hay elementos que siempre son evaluados y que pueden corresponder a manifestaciones de dolor, especialmente en la población de menor edad (menores de 7 años).
Es importante señalar que en la evaluación utilizada están claramente definidos conceptos que son usados coloquialmente en forma indistinta, como actividades de vida diaria, discapacidad, participación, minusvalía y restricción, según la clasificación CIF (Tabla 9) desarrollada por la OMS (34).
.png)
.png)
4. Pautas de Manejo Farmacológico del DNL
El tratamiento farmacológico en DNL suele ser complejo y en ocasiones inadecuado.
La literatura europea y norteamericana aporta guías, algoritmos de tratamiento y recomendaciones para el manejo y tratamiento del DN (3, 4, 5, 7).
Sin embargo, en América Latina, la prescripción y la disponibilidad de medicamentos y de recursos están supeditadas por regulaciones de las entidades de Salud, que aprueban en forma restringida la inclusión de medicamentos y equipos.
Las recomendaciones consideradas por el Consenso se basan en la evidencia científica publicada y toman en consideración
la disponibilidad de las alternativas farmacológicas en Chile en particular y en los países de la región (35).
Es importante establecer inicialmente los objetivos de un tratamiento farmacológico y tener una línea adecuada para disminuir el dolor utilizando los fármacos con un esquema terapéutico de la mayor eficiencia, seguridad y que fomente la adhesividad al tratamiento, lo cual determinará una mejora en la calidad de vida y en la funcionalidad de los pacientes (9,36,37,38).
Es por eso que en este Consenso optamos por algunas presentaciones o algunos fármacos por sobre otros.
4.1 Opciones Terapéuticas
Los fármacos más utilizados corresponden a cuatro categorías: terapias tópicas, neuromoduladores, antidepresivos y opioides (Tabla 10).
Desde el inicio pueden utilizarse diferentes asociaciones, dependiendo de la disponibilidad/accesibilidad y tolerabilidad de los medicamentos y de la evolución del tratamiento. Atendiendo a sus diferencias en las reacciones y los mecanismos de acción, el Consenso integra los fármacos disponibles para el tratamiento de DNL en dos grupos: fármacos tópicos y los fármacos sistémicos.
Siguiendo el modelo establecido por el Grupo Latinoamericano de Dolor Neuropático (10), los medicamentos utilizados se clasifican en grupos denominados A, B, C y D, organizados en función de la eficacia para cada cuadro neuropático en particular (Tabla 11).
4.2 Terapias Tópicas
Las recomendaciones de primera línea en el Consenso, dentro de los fármacos tópicos, es el parche de lidocaína 5%; y dentro de los fármacos sistémicos, los antidepresivos, particularmente la amitriptilina.
Los fármacos tópicos maximizan la concentración del fármaco en los tejidos afectados (fibras nerviosas, receptores, etc.), optimizando el efecto terapéutico y reduciendo las concentraciones sistémicas del fármaco, minimizando así el riesgo de efectos secundarios y de interacciones farmacológicas.
La fortaleza de las terapias tópicas para el manejo del DNL radica en su seguridad y tolerabilidad, así, por ejemplo, una serie de ensayos clínicos realizados con el parche de lidocaína mostraron significativamente menor incidencia de efectos adversos comparativamente con pregabalina (14).
.png)
.png)
La aplicación tópica del medicamento “en el sitio que duele” contribuye a la satisfacción del paciente y a la adhesividad al tratamiento porque es muy bien aceptada.
Al hacer recomendaciones de uso, principalmente a médicos generales, que no están siempre habituados a manejar estas distintas opciones terapéuticas, hay que hacer distinción entre las reacciones y los mecanismos de acción de las preparaciones tópicas y de las transdérmicas.
4.3 Diferenciación entre administración tópica y transdérmica.
• La aplicación tópica implica la aplicación directa sobre el área del dolor, buscando solamente efecto local y no sistémico.
• El uso transdérmico es la aplicación sobre la piel, pero buscando un efecto sistémico, es decir, el objetivo es que las concentraciones plasmáticas alcancen un nivel terapéutico (Tabla 12).
.png)
4.4. Algoritmo de Manejo Farmacológico del DNL
El grupo de Consenso deliberó el esquema general de tratamiento con referencia al algoritmo general de diagnóstico de DN (5), que determina primero si el sujeto tiene dolor neuropático o no, y si este es predominante o solamente DNL (Figura 7).
Estas guías de tratamiento deben ser aplicadas con flexibilidad, evitando pautas terapéuticas rígidas y de esta forma poder individualizar la terapia (Tabla 13), considerando los efectos benéficos o deletéreos de los medicamentos y su rapidez de acción para los casos en los cuales es imperativo el alivio rápido del dolor (39) (Figura 8).
El Consenso excluyó algunos fármacos presentes en anteriores recomendaciones, ya sea por la baja disponibilidad en el mercado o la poca evidencia que tenían de ser efectivos en el dolor neuropático localizado.
.png)
.png)
Dolor Lumbar
En el dolor lumbar, se estima que un porcentaje de las lumbalgias tiene componente neuropático (15%). Este puede aparecer asociado con dolores miofasciales o incluso radiculares. En estos casos solamente se considera el uso de parches cuando se trate de una manifestación de dolor neuropático localizado.
Neuralgia Post Herpética
Los parches de lidocaína han demostrado ser muy eficientes en estos casos y pueden ser utilizados sobre la piel indemne, sin lesiones cruentas que circundan a las zonas afectadas con lesiones cutáneas activas.
Dolor Lumbar con Componente Neuropático
En estos casos solamente se considera el uso de parches de lidocaína si tienen manifestaciones de DNL.
Se considera como 1ª línea el uso de AINEs por cortos periodos (máximo 2 semanas), asociado con amitriptilina (Evidencia tipo IA).
Combinarlo con opioides, es una alternativa, si el dolor es muy severo o se exacerba. Si la respuesta es insuficiente se sugiere la combinación con gabapentina o pregabalina.
Neuralgia del Trigémino
La carbamazepina y oxcarbazepina son los fármacos de elección en el tratamiento de la neuralgia del trigémino que cursa con crisis lancinantes de gran intensidad. Si la respuesta es insuficiente, pueden agregarse analgésicos opioides.
El parche de lidocaína puede asociarse con el respaldo de evidencia indirecta derivada de su empleo en dolor neuropático fascial de origen postherpético (Nivel de evidencia tipo IC).
En última instancia, ante la imposibilidad de un control adecuado del dolor o la aparición de efectos adversos inaceptables, puede optarse por el tratamiento intervencionista (ver capítulo 6).
Otros Dolores Neuropáticos
Dolor neuropático postquirúrgico y cicatriz dolorosa
El uso de tratamiento tópico puede ser utilizado como monoterapia en estos casos.
DN en Sida
La lamotrigina ha demostrado mayor efectividad que otros fármacos.
.png)
Recomendaciones en el Manejo de DNL (Figura 8)
• Se recomienda el uso por un mínimo de 3 semanas, sugiriendo 4, para el grupo A y los opioides; y de 6 semanas para el resto de los grupos, antes de definir un cambio del esquema. Deberá considerarse la farmacocinética y la farmacodinamia de cada fármaco para cada paciente.
• Debe modificarse en base a la seguridad de la farmacoterapia, lo cual determina cambio en las dosis o suspensión del alguno de los fármacos.
• El parche de lidocaína no requiere titulación y puede
usarse por períodos prolongados en forma segura.
• Las metas terapéuticas deben monitorearse a través de evaluaciones clínicas o telefónicas con una frecuencia al menos semanal. Se recomienda al menos utilizar la escala EVA o Numérica, además de la reducción del área dolorosa y considerar la presencia de alodinia e hiperalgesia.
(Acevedo 2008) (10)
• Se recomienda la vigilancia estricta en la aparición de efectos adversos, por ejemplo las alteraciones cardiovasculares en el uso de antidepresivos tricíclicos (ADTC).
• Se sugiere manejo preventivo de síntomas prevalentes asociados al uso de algunos fármacos como estreñimiento, náuseas y vómitos en el caso de opioides.
• Las metas terapéuticas serán variables de acuerdo a la intensidad y duración de los síntomas y las expectativas consensuadas con cada paciente.
• El logro de las metas planteadas no necesariamente implica la suspensión del tratamiento, el cual puede mantenerse por el tiempo que sea necesario. Frente a la estabilización del cuadro clínico, este consenso recomienda
evaluar una suspensión progresiva del tratamiento.
5. Pautas para el manejo no Farmacológico del DNL Aunque existe aún poca evidencia del manejo no farmacológico de DNL, este Consenso recomienda que el tratamiento de DNL debiera tener siempre un enfoque polimodal (Figura 9), en una estrategia de trabajo multi, inter o transdisciplinaria y con un contexto psicosocial (participación protagónica del paciente, la familia y del entorno).
En este esquema multimodal, se reconoce al manejo no farmacológico su utilidad para aliviar el dolor, mejorar la función y el equilibrio somático, tratar la deficiencia (prevención secundaria), evitar la discapacidad (prevención terciaria), facilitar la reinserción socio-laboral temprana, mejorar de la calidad de vida y disminuir de la utilización de recursos sanitarios. Se enfatiza asimismo, la mejoría en la calidad del sueño.
Como el propósito de estas guías es específicamente el manejo del dolor neuropático localizado (DNL), el Consenso revisó algunas publicaciones sobre el uso de distintos procedimientos
FIGURA 9. Enfoque Polimodal Interdisciplinario.
no farmacológicos en DN provenientes de la Psicología, de la Medicina Física, de Enfermería y se refiere también a las Terapias Complementarias. Finalmente se hizo referencia a los Procedimientos Invasivos (Figura 10).
Las evidencias de estas alternativas en DNL son diversas y generalmente se sitúan en los niveles III y IV. Sin embargo, algunas de ellas han mejorado al respecto y se espera que en los próximos años se incremente la investigación y el apoyo para realizarla.
La Psicología del Dolor ha tenido un gran desarrollo en los últimos años por su fuerte asociación al campo de las Neurociencias, tanto en contextos experimentales como clínicos. Se destacan distintos procedimientos bien controlados que pueden agruparse bajo el concepto de Técnicas de Regeneración Visual (40) y donde la mayoría de ellas se sustenta en la neuroplasticidad del cerebro y en el modelo de la Neuromatriz de la Conciencia Corporal (41). A ellos se complementa la terapia cognitiva-conductual y la psicoterapia
.png)
de apoyo individual o grupal (42,43). Son de particular importancia también los métodos para reducir el estrés y mejorar la calidad del sueño (44).
Entre las técnicas de regeneración visual, la terapia en espejo cuenta con evidencia creciente (6), la cual también es ampliamente utilizada por medicina física y rehabilitación. Los estudios señalan un alivio significativo del dolor en miembro fantasma y dolor regional complejo (45). Se espera en los próximos años el incremento de la investigación en esta técnica cuyo objetivo es favorecer la homeostasis de la Neuromatriz.
En la misma dirección investigativa y clínica, el Neurofeedback es una técnica diseñada para reducir el componente emocional del dolor (y por lo tanto la intensidad percibida), utilizando para ello Resonancia Magnética Funcional (RMF), que permite al sujeto influir directamente sobre las áreas cerebrales moduladoras (corteza cingulada) con su sistema visual (46). Otro procedimiento de creciente utilización es la Realidad Virtual (RV), con algunos resultados importantes en pacientes con quemaduras (47). También otros estudios avalan la utilización de la analgesia hipnótica (48); por último y también con creciente evidencia, se investiga en el perfeccionamiento de la técnica denominada Imaginería Motora Graduada, donde se reporta eficacia para dolor regional complejo (42).
Medicina Física y Rehabilitación utiliza ampliamente también la terapia espejo; la revisión sistemática encontró 6 ECR Clase I y 7 series de casos clínicos Clase IV (45). Con respecto a estimulación nerviosa eléctrica transcutánea (49) o percutánea (50), hasta la fecha solamente hay evidencia en neuropatía diabética dolorosa (49). Clínicamente se recomienda en demás tipos de DNL por ausencia de efectos adversos. Con respecto al ejercicio, algunos reportes sugieren beneficios (51), sin embargo el Consenso recomienda utilizar éste, finalizada la etapa aguda.
Enfermería desde el punto de vista de la Gestión del Cuidado del Enfermo y de su familia, incluye educación y reforzamiento del tratamiento (paciente/familia), por ejemplo, en el vestuario del paciente y en el uso de terapias tópicas, para optimizar la adhesión al tratamiento; seguimiento del paciente con contacto telefónico, controles y con un trabajo de enfermería tanto intrahospitalario como domiciliario, tomando en cuenta que en la realidad de la Salud Pública de Chile y de la región, no todos los pacientes pueden ser o permanecer hospitalizados. Asimismo, contribuye a optimizar el confort, higiene y seguridad, para disminuir las posibilidades de descompensación, tanto metabólicas como locales o que lleven a un mal uso del tratamiento, considerando hidratación de la piel, intervenciones de enfermería en caso de concomitancia de lesiones localizadas y evaluación del dolor del enfermo (con escalas visuales).
Las Terapias Complementarias son diversas y existen publicaciones en literatura científica sobre el uso en DNL de algunas terapias complementarias, como la acupuntura (52, 53), pero está pendiente su grado de evidencia. Entre otras terapias complementarias, se mencionan: Fitoterapia, Terapia Biorreguladora (Homotoxilicología), Terapia Neural, Homeopatía, Reflexología, de las que no se encuentra evidencia
por el momento. Se destaca que el Ministerio de Salud en Chile ha aprobado la aplicación de 5 terapias complementarias en los servicios públicos de Salud para el manejo del dolor: Acupuntura, Homeopatía, Quiropraxia, Naturopatía y Terapia Floral (54).
6. Procedimientos Intervencionistas en DNL
Los Procedimientos Intervencionistas sólo se incluyen como un apartado especial a esta guía de DNL. Existen pocos estudios acerca de la eficacia y seguridad de los procedimientos intervencionistas en dolor neuropático, menos aún en dolor neuropático localizado. Una revisión detallada de este tópico está fuera del alcance de esta Guía.
En general, el uso de técnicas invasivas se realiza cuando fracasa total o parcialmente el tratamiento farmacológico y no farmacológico. Para ello es conveniente que estos pacientes sean derivados a centros especializados en este tipo de tratamientos (Unidades de Tratamiento del Dolor) (10, 14, 55).
Hay guías con algoritmos para diferentes síndromes de dolores neuropáticos. Entre las terapias invasivas utilizadas en dichos algoritmos, existen desde procedimientos poco invasivos a muy especializados. En general, se pueden utilizar en caso de dolor con distribución anatómica precisa o síndromes regionales (10).
El uso de infiltraciones con anestésicos locales combinados con corticoides aplicados en el nervio, neuromas o cicatrices dolorosas para tratamiento de dolor localizado neuropático de diferentes etiologías es una práctica frecuente. Si bien hay buenos resultados, no hay protocolos de investigación que le den un soporte de evidencia positiva a largo plazo.
Los bloqueos del nervio normalmente proporcionan alivio temporal debido al efecto anestésico. El corticoide puede ayudar a reducir el edema de los tejidos que rodean al nervio y que contribuyen en la irritación de éste y al dolor (56). Los bloqueos neurales como el bloqueo peridural, es recomendado para pacientes con dolor radicular que pueden producir DNL, síndrome de cirugía lumbar fallida y neuralgia post-herpética. Los bloqueos simpáticos se han utilizado en el síndrome de dolor regional complejo y también en la neuralgia post- herpética.
Si bien hay resultados positivos, la evidencia no es suficiente para indicar estos bloqueos como “gold standard” en el SDRC (57). El uso de fármacos intratecales como anestésicos locales, opioides y ziconotida (58) han mostrado utilidad en neuralgia post-herpética, neuropatía diabética dolorosa, lesión de médula espinal, síndrome de cirugía lumbar fallida y síndrome doloroso regional complejo.
La toxina botulínica tipo A podría inducir un efecto analgésico en pacientes con dolor neuropático, independiente de su efecto en el tono muscular. Esto permitiría sugerir una nueva indicación para BTX-A en analgesia (59). La estimulación eléctrica medular en síndrome doloroso regional complejo y síndrome de cirugía lumbar fallida, y la estimulación de corteza motora ha mostrado cierta eficacia en algunos dolores centrales (Ej: AVE) (60).
En conclusión, no hay estudios específicos en dolores neuropáticos localizados y, por lo tanto, no hay una evidencia científica que permita la generalización del uso de estos procedimientos invasivos. No obstante lo anterior, se deben considerar estas terapias cuando han fracasado los tratamientos conservadores.
Conclusión
• El Dolor Neuropático Localizado (DNL) es una entidad que requiere un manejo diferencial, pues no justifica la exposición innecesaria, excesiva o prematura a los analgésicos sistémicos.
• El manejo del DNL debe ser individualizado tomando en cuenta la eficacia, perfil de tolerabilidad y seguridad de los medicamentos usados y la accesibilidad a los fármacos incluyendo los costos.
• La tendencia general es favorecer la terapia multimodal y balanceada, empleando métodos farmacológicos y no farmacológicos, prefiriendo el manejo local y la terapia combinada y buscando maximizar la eficacia y reducir los efectos adversos.
• El parche de lidocaína al 5% es fármaco de primera línea (como monoterapia o en terapia combinada) en síndromes dolorosos localizados cuando el dolor es superficial y cuando prevalece la alodinia.
• Los analgésicos opioides se deben siempre considerar para el manejo del dolor severo o las crisis de dolor.
• Los antidepresivos preferidos son los antidepresivos triciclitos, pero su empleo debe ser cuidadoso atendiendo aspectos de tolerabilidad y seguridad.
• Los gabapentinoides son apropiados como segunda línea de manejo, pero pueden ser primera línea de manejo en caso de no poder usar antidepresivos.
• Los nuevos antidepresivos (venlafaxina, duloxetina) son también una alternativa a los antidepresivos tricíclicos.
• Por la dificultad que puede significar para médicos generales diferenciar y definir cuáles dolores neuropáticos son localizados, este Consenso recomienda aplicar una encuesta en Chile para medir tendencias.
• Por su valor coadyuvante en el diagnóstico diferenciado de DNL, se sugiere validar como herramienta complementaria el cuestionario de impacto emocional (CIE-6), aquí presentado.
Referencias Bibliográficas
1. Guevara U, Covarrubias A, García G, Hernández S; Parámetros de práctica para el manejo del dolor neuropático. Rev. Inv. Clínica 2006; 58(2): 126-38.
2. Ruiz F, Carrasco ML. El dolor neuropático en la consulta médica
en América Latina: resultado de una encuesta en cinco países. Rev Iberoamericana Dolor 2010; Aceptado para publicación. www. revistaiberoamericanadedolor.org
3. Dworkin HR, Connor A, Backonja M, Farrar JT, Finnerup NB, Jensen TS, et al. Pharmacologic management of neuro-pathic pain: Evidence-based recommendations. Pain (2007), doi:10.1016/j. pain.2007.08.033.
4. Moulin DE, Clark AJ, Gilron I, Ware MA, Watson CP, Sessle BJ, Coderre T, Morley-Forster PK, Stinson J, Boulanger A, Peng P, Finley GA, Taenzer P, Squire P, Dion D, Cholkan A, Gilani A, Gordon A, Henry J, Jovey R, Lynch M, Mailis-Gagnon A, Panju A, Rollman GB, Velly A; Canadian Pain SocietyPharmacological management of chronic neuropathic pain - consensus statement and guidelines from the Canadian Pain Society. Pain Res Manag. 2007 Spring;12(1):13-21.
5. Finnerup NB, Otto M, Jensen TS, Sindrup SH. Algorithm for neuropathic pain treatment: an evidence based proposal. Pain 2005;118:289–305.
6. Bouhassira D, Attal N, Alchaar H, et al. Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diagnostic questionnaire (DN4). Pain 2005;114:29-36.
7. N. Attal, G. Cruccu, M. Haanpää, P. Hansson, T. S. Jensen,
T. Nurmikko, C. Sampaio, S. Sindrup, P. EFNS guidelines on pharmacological treatment of neuropathic pain. European Journal of Neurology. Volume 13, Issue 11, pages 1153–1169, November 2006.
8. Aguilera-Muñoz J, Arizaga-Cuesta E, Carpio-Rodas A, Crump J, Díaz-Heredia F, Fernández CF, Griego JM, Guerrero D, Hincapié M, León MX, Moyano J, Navarro-Chávez M, Rangel-Galvis CE, Rodríguez R, Salazar-Bolaños E, Sarmiento A, Terán Saá-Jaramillo D, Tettamanti D, Valencia D, Vargas-Gómez JJ. Asociación Colombiana para el Estudio del Dolor, Bogotá, Colombia. Guías para el Manejo ddel Dolor Neuropática. Rev Neurol. 2005 Mar 1-15;40(5):303-16.
9. Asociación Venezolana para el Estudio del Dolor (AVED). (2008) Consenso venezolano sobre dolor neuropático.
10. Acevedo C, Amaya A, De León Casasola O, Chinchilla N, et al. Guías para el diagnóstico y el manejo del dolor neuropático: consenso de un grupo de expertos latinoamericanos. RID 2008; 2: 15-46.
11. El Método Delphi. http://www.gtic.ssr.upm.es/encuestas/delphi.
htm.
12. Treede RD, Jensen TS, Campbell JN, Cruccu G, Dostrovsky JO, Griffn JW, Hansson P, Hughes R, Nurmikko T, Serra J. Neuropathic pain. Redefnition and a grading system for clinical and research purposes. Neurology 2008; 70(18): 1630-5.
13. Hernández JJ y Moreno C. Dolor neuropático, la gran incógnita. En: Dolor neuropático: fisiopatología, diagnóstico y manejo. Editores: Hernández JJ y Moreno C. Editorial Universidad del Rosario. Colombia 2006; pp. 20-31.
14. Baron R. Neuropathic pain: diagnosis, pathophysiological mechanisms, and treatment Lancet Neurol 2010; 9: 807–19.
15. Sadosky A, McDermott AM, Brandenburg NA, Strauss M. A review of the epidemiology of painful diabetic peripheral neuropathy, postherpetic neuralgia, and less commonly studied neuropathic pain conditions. Pain Pract. 2008 Mar;8(1):45-56. Review.
16. Maija Haanpää, Nadine Attal, Miroslav Backonja, Ralf Baron, Michael Bennett, Didier Bouhassira, Giorgio Cruccu, Per Hansson, Jennifer A. Haythornthwaite, Gian Domenico Iannetti, Troels S. Jensen, Timo Kauppila, Turo J. Nurmikko, Andew S.C. Rice, Michael Rowbotham, Jordi Serra, Claudia Sommer, Blair H. Smith, Rolf-Detlef Treede. NeuPSIG guidelines on neuropathic pain assessment Review Article. PAIN, Volume 152, Issue 1, January 2011, Pages 14-27
17. Barrett AM. 2007. Epidemiology, public health burden, and
treatment of diabetic peripheral neuropathic pain: a review. Pain Med. 2007 Sep;8 Suppl 2:S50-62.
18. Mick G, Baron R, Finnerup N, Hans G, Kern K, Dworkin RH. Consenso Europeo de DNL: Localized neuropathic pain – a question of definition. Marzo 2010, en proceso de publicación. (Definición de DNL)
19. Bouhassira D, Attal N. Diagnosis and assessment of neuropathic pain: The saga of clinical tools. Pain 2011, 152: S74-S83. (Estrategia de Dos Pasos, Todo el tema: Historia, Examen Físico y Exámenes Complementarios)
20. Bouhassira D, Lanteri-Minet M, Attal N, Laurent B, Touboul C. Prevalence of chronic pain with neuropathic characteristics in the general population. Pain 2008;136:380–7. (Historia: DN4 Interview)
21. Bouhassira D, et al. Development and validation of the neurophatic pain symptom inventory. Pain 2004, 108: 248-257. (Evaluación Clínica de la Alodinia)
22. Bouhassira D, et al. Development and validation of the neurophatic pain symptom inventory. Pain 2004, 108: 248-257. (Evaluación Clínica de la Alodinia)
23. Correa G, et al. Treatment of localized post-traumatic neuropathic pain in scars with 5% lidocaine medicated plaster. Local and regional anesthesia 2010 (3): 77-83. (Examen Físico; Demarcación y reproductibilidad de área dolorosa)
24. Hansson P, Backonja M, Bouhassira D. Usefulness and limitations of quantitative sensory testing: Clinical and research application in neuropathic pain states. Pain 2007, 129 : 256–259. (Exámenes Complementarios)
25. Singleton, JR. .Evaluation and Treatment of Painful Peripheral Polyneuropathy. Seminars in Neurology 2005, 25: 185-195. (Exámenes Complementarios)
26. Walk D. Role of Skin biopsy in the diagnosis of peripheral neuropathic pain. Current Pain and Headache Reports 2009, 13: 191-
196. (Exámenes Complementarios)
27. Wong, Donna. and Baker, Connie Morain: Pain in children: comparison of assessment scales, Pediatric Nursing, 14(1):9-17, 1988.
Walco GA, Howite NT. Vertical vs. horizontal visual analog scales of
pain intensity in children. J Pain Symptom Manage 1991; 6:200.
28. Underuse of Analgesia in Very Young Pediatric Patients With Isolated Painful Injuries. Alexander J, Manno M. Ann Emerg Med. 2003;41:617-622
29. Pediatric Pain Control Practices of North American Burn Centers. Martin-Herz SP, Patterson DR, Honari S, Gibbons J, Gibran N, Heimbach DM. J Burn Care Rehab, jan 2003, 24(1): 26 – 36.
30. Burn Injury Pain: The Continuing Challenge. Summer GJ, Puntillo KA, Miaskowski C, Green PG, Levine JD. Journal of Pain, jul 2007, (7): 533 – 548.
31. Current status of Pain Management in Children. Howard RF. JAMA, nov 2003, 290(18): 2464 – 2469.
32. Neuropathic Pain in Children: Special Considerations. Walco GA, Dworkin RH, Krane EJ, LeBel AA, Treede RD. Mayo Clin Proc, mar 2010, 85(3)(suppl): S33 – S41.
33. Scratching the surface – Managing the itch associated with burns: A review of current knowledge. Brooks JP, Malic CC, Judkins KC. Burns, 2008, 34: 751 – 760.
34. Clasificación Internacional del Funcionamiento, de la Discapacidad y de la Salud, (CIF) de la OMS en la resolución WHW 54.21 del 22 de mayo del 2001.
35. EFNS guidelines on the pharmacological treatment of neuropathic pain: 2010 revision. Attal N, Cruccu G, Baron R, Haanpää M, Hansson P, Jensen TS, Nurmikko T; European Federation of Neurological Societies. Euro J Neurol. 2010 Sep;17(9):1113-e88.
36. [Guidelines for the clinical management of neuropathic pain (II)]. Guías Clínicas para el Manejo de Dolor Neuropático. Aguilera- Muñoz J, Arizaga-Cuesta E, Carpio-Rodas A, Crump J, Díaz-Heredia F, Fernández CF, Griego JM, Guerrero D, Hincapié M, León MX, Moyano J, Navarro-Chávez M, Rangel-Galvis CE, Rodríguez R, Salazar-Bolaños E, Sarmiento A, Terán Saá-Jaramillo D, Tettamanti D, Valencia D, Vargas- Gómez JJ. Rev Neurol. 2005 Mar 1-15;40(5):303-16.
37. Dolor Neuropático Localizado: Conceptualización y Manejo en la Práctica Médica General. Sociedad Ecuatoriana para Estudio y Tratamiento del Dolor. Reyes E, Ruiz F, editores. 2010. No publicado.
38. Dolor neuropático localizado, conceptualización y manejo en la práctica médica general: consenso de un grupo de expertos. Danilo Pasternak, Fernando Sánchez, Antonio Sánchez, Esteban Reyes, Jorge Chehab, Iván Orellana, Manuel Sempértegui, Luis Cifuentes, Carlos Heredi, Jacqueline Macías, Gustavo Munizaga. Rev. Iberoamericana del Dolor Vol. 5, No. 1, 2010.
39. Guías para el diagnóstico y el manejo del dolor neuropático: Consenso de un grupo de expertos latinoamericanos. Ruiz F, Guzmán S, Vargas J, Gómez-Barrios J., editores. 2009. No publicado.
40. Ramachandran, V. & Altschuler, E. (2009). The use of visual feedback, in particular mirror visual feedback, in restoring brain function. Brain, 132, 1693-1710.
41. Melzack R. From the gate to the neuromatrix. Rev. Soc. Esp. Dolor 2000; 7: 149-156.
42. Moseley GL. Graded motor imagery is effective for longstanding complex regional pain syndrome: a randomised controlled trial. Pain 2004; 108:192-8.
43. Evans S, Fishman B, Spielman L, et al. Randomized trial of cognitive behavior therapy versus supportive psychotherapy for HIV- related peripheral neuropathic pain. Psychosomatics 2003;44:44-50.
44. Dworkin HR, Connor A, Backonja M, Farrar JT, Finnerup NB, Jensen TS, et al. Pharmacologic management of neuropathic pain: Evidence-based recommendations. Pain (2007), doi:10.1016/j. pain.2007.08.033.
45. Andreas Stefan Rothgangel, Susy M. Braun, Anna J. Beurskens, Rudiger J. Seitz and Derick T. Wade. The clinical aspects of mirror therapy in rehabilitation: a systematic review of the literature. International Journal of Rehabilitation Research 2011, 34:1–13.
46. Ibric, V.L. And Dragomirescu, L.G. (2008). “Neurofeedback in Pain Treatment” chapter 16 IN “Introduction to Quantitative EEG and Neurofeedback–Advanced theory and Applications”, second edition (eds. Thomas Budzynski, Helen Budzynski, James Evans and Andrew Abarbanel, ISBN.
47. Hoffman, H.G., Richards, T.L., Coda, B., Bills, A.R., Blough, D., Richards, A.L. and Sharar, S.R. (2004). Modulation of thermal pain-related brain activity with virtual reality: evidence from fMRI. Neuroreport., 15(8),1245-1248.
48. Crawford, H., Knebel, T. & Vendemia, J. (1999). La naturaleza de la analgesia hipnótica: Bases y evidencias neuropsicológicas. Anales de psicología año/ Vol. 15, número 001, Universidad de Murcia, España.
49. Kumar D, Marshall HJ. Diabetic peripheral neuropathy: amelioration of pain with transcutaneous electrostimulation. Diabetes Care 1997; 20:1702-5.
50. Ghoname EA, White PF, Ahmed HE, et al. Percutaneous electrical nerve stimulation: an alternative to TENS in the management of sciatica. Pain 1999; 83:193-9.
51. Sherry DD, Wallace CA, Kelley C, et al. Short- and longterm outcomes of children with complex regional pain syndrome type I treated with exercise therapy. Clin J Pain 1999;15:218-23.
52. Matias Vested Madsen, physician, Peter C Gøtzsche, director, Asbjørn Hróbjartsson. Acupuncture treatment for pain: systematic review of randomised clinical trials with acupuncture, placebo acupuncture, and no acupuncture groups. BMJ 2009; 338:a3115.
53. Brian M. Berman, M.D., Helene M. Langevin, M.D., Claudia M. Witt, M.D., M.B.A., and Ronald Dubner, D.D.S., Ph.D. Acupuncture for Chronic Low Back Pain. N Engl J Med 2010; 363:454-61.
54. Prácticas Médicas Alternativas. Minsal. Decreto ley 42, Diario Oficial de Chile, 17 de junio, 2005.
55. J.R. González – Escalada et al Rev Soc Esp Dolor. 2009; 16(8): 445-467
56. Vlassakov KV, Narang S, Kissin I. Local anesthetic blockade of peripheral nerves for treatment of neuralgias: systematic analysis. Anesth Analg. 2011 Jun;112 (6):1487-93. Epub 2011 Mar 3.
57. Cepeda M Soledad, Carr Daniel B, Lau Joseph. Local anaesthetic sympathetic blockade for complex regional pain syndrome. Cochrane Database of Systematic Reviews. In: The Cochrane Library, Issue 06, Art. No. CD004598. DOI: 10.1002/14651858.CD004598.pub4.
58. Wallace MS, Rauck RL, Deer T. Ziconotide combination intrathecal therapy: rationale and evidence. Clin J Pain 2010; 26: 635-44.
59. Ranoux D, Attal N, Morain F, Bouhassira D.Botulinum toxin type A induces direct analgesic effects in chronic neuropathic pain Ann Neurol. 2008 Sep;64(3):274-83.
60. Cruccu G, Aziz TZ, Garcia-Larrea L, et al. EFNS guidelines on neurostimulation therapy for neuropathic pain. Eur J Neurol 2007; 14: 952-70.
61. Busse K. Importance of localized neuropathic pain when treating neuropathic pain conditions. Poster presentedo en NeuPSIG Mayo 2010. Atenas, Grecia. Prevalencia de DNL. Encuesta realizada en Europa del Este. European Journal of Pain Supplements, Volume 4, Issue 1, April 2010, Page 78.
ANEXO I: GLOSARI0
• Alodinia estática: Dolor producido por un estímulo que habitualmente no origina dolor.
• Analgesia: Pérdida de sensibilidad en parte o totalidad del cuerpo, producida por una lesión en el sistema nervioso o por agentes anestésicos.
• Anticonvulsivante: Medicamento para el manejo de la epilepsia. Por sus mecanismos de acción son utilizados para tratamiento de neuropatías dolorosas.
• Disestesia: Sensación anormal, desagradable para el paciente que puede ser espontánea o provocada.
• Dolor agudo: Se define como el dolor que desaparece al curar, tiene un fin predecible y es corto en duración.
• Dolor crónico: Dolor que persiste o progresa sobre un largo período (usualmente más de 3-6 meses) y continúa por más tiempo del período normal de recuperación.
• Dolor superficial: Dolor que afecta a piel y mucosas.
• Hiperalgesia: Respuesta aumentada a un estímulo doloroso.
• Hiperpatía: Síndrome doloroso, caracterizado por reacción aumentada a estímulos, especialmente los repetitivos.
• Hipoalgesia: Sensibilidad disminuida al estímulo nociceptivo.
• Hipoestesia: Sensibilidad disminuida a la estimulación sensorial.
• Hiperestesia: Sensibilidad aumentada a estímulos sensoriales.
• Neuralgia: Dolor en la zona de distribución de uno o varios nervios.
• Neuritis: Inflamación de un nervio o nervios.
• Neuroma: Tumor formado por tejido nervioso, generalmente a expensas de la neuroglia, o de las células de Schwann, que forman la vaina de mielina.
• Neuropatía: Alteración patológica de un nervio (mononeuropatía, neuropatía múltiple, polineuropatía).
• Parestesia: Sensación anormal, de tipo prurito, calambre u hormigueo, no relatada como experiencia dolorosa, pero molesta.
• Radiculopatía: Proceso patológico que afecta a las raíces espinales de los nervios periféricos.






