Etiquetas
#pandemia #COVID-19 #triaje #toma de decisiones #comorbilidades #cuidados paliativos #Dolor crónico #Neurocirugía #Síndrome de Fracaso de Cirugía Espinal Lumbar #anestesia espinal unilateral #dosis mínima #lateralización #cirugía traumatológica ambulatoria #nervio pudendo #neuralgia #radiofrecuencia pulsada; ultrasonido. #dolor #dolor neuropatico #topiramato #dolor agudo postquirúrgico #dolor incisiona #anestesia #niños #dolor agudo #dolor quirurgico #modelos y teorias #enfermeria #noticias #Investigación en Servicios de Salud #Rehabilitación #ansiedad #emociones #miedo #tristeza #Parche #Buprenorfina #Fentanilo #problemas sociales #síndrome pediátrico inflamatorio multisistémico #fibromialgia #narrativas #experiencia #Afrontamiento #estados emocionales #dolor de espalda #Cuidado paliativo #opioidesRevista El Dolor 61 | Julio 2014 - Año 24 | Revisiones Bibliográficas
Síndrome de Dolor Regional Complejo
Aceptado: 19-01-2015
Páginas 36-44
Cardemil, Carolina (1)
(1) Médico Anestesiólogo.
El Síndrome de Dolor Regional Complejo (SDRC) es una enfermedad crónica, que se caracteriza por dolor y alteraciones sensitivas, motoras y autonómicas, a menudo sigue a un trauma, su curso y fisiopatología son variables. El objetivo de esta revisión es presentar una actualización de los aspectos generales de la enfermedad y mostrar la evidencia existente en relación a las alternativas terapéuticas.
Palabras clave: Síndromes de Dolor Regional Complejo, Distrofia Simpática Refleja, Causalgia.
The Regional Pain Syndrome Complex (CRPS ) is a chronic disease, which is characterized by pain and sensory, motor and autonomic disturbances, often follows trauma, the course and the pathophysiology are variable.
The aim of this review is to provide an update on the general aspects of the disease and show the evidence in relation to therapeutic alternatives.
Key words: Complex Regional Pain Syndromes, Reflex Sympathetic Dystrophy, Causalgia.
El Síndrome de Dolor Regional Complejo (SDRC) es una enfermedad crónica, que se caracteriza por dolor y alteraciones sensitivas, motoras y autonómicas, a menudo sigue a trauma de un miembro, su curso es variable y, tanto su fisiopatología como el tratamiento, no están claramente establecidos.
El objetivo de esta revisión es presentar una actualización de los aspectos generales de la enfermedad y mostrar parte de la evidencia existente en relación a las alternativas terapéuticas de la misma, tanto las conservadoras como las intervencionales.
Es importante tener en consideración algunos puntos que limitan el objetivo de obtención de evidencia de buena calidad para el tratamiento de este síndrome.
Lo primero es que el diagnóstico es clínico y los criterios para realizarlo han variado en el tiempo. Segundo, es la ausencia de criterios estandarizados para medir los resultados al tratamiento. Y, por último, ya que se trata de un síndrome crónico cuya manifestación principal es el dolor, existe respuesta a placebo.
I. Definición según la International
Association for the Study of Pain IASP (1):
“Conjunto de condiciones dolorosas que aparecen localmente seguidas de un trauma, la mayoría de las veces distalmente y que exceden en intensidad y duración el curso clínico esperado del trauma original, a menudo resultando en un deterioro considerable en la función motora. El SDRC es caracterizado por una progresión variable en el tiempo”.
II. Historia
Los primeros reportes que existen de SDRC fueron de Mitchell quien, en el año 1872, introdujo el término de Causalgia (2). A principios del siglo XX Sudeck, un cirujano alemán, publicó un artículo sobre una “distrofia ósea postraumática” (41). En 1943, Evans acuña el término Distrofia Simpática Refleja (3), estableciendo de esa manera un rol fisiopatológico central del Sistema Nervioso Simpático (SNS) en el inicio y mantención de la enfermedad. Estudios posteriores han señalado que el SNS no siempre está involucrado, al menos no en todas las etapas de la enfermedad, además, el arco reflejo que explicaba su etiopatogenia nunca ha sido demostrado (64). Es así como en 1993 la IASP, en una reunión de consenso, cambia el nombre a Síndrome de Dolor Regional Complejo, que es el que se mantiene hasta el día de hoy.
En 2007, la IASP (Consenso de Budapest) establece los
criterios diagnósticos definitivos para el síndrome.
Tipos:
Tipo I: sin daño demostrable nervioso. Tipo II: con daño demostrable.
Tipo III: Not otherwise Specified (NOS), es el que no cumple todos criterios diagnósticos, pero que tampoco tiene otro diagnóstico.
III. Epidemiología
Existen dos trabajos epidemiológicos que permiten tener una idea de la incidencia del SDRC. El primero, publicado en el 2003 (6), donde se registran todos los casos que habían existido de SDRC en el curso de 10 años (1989-1999) en una población de alrededor de 100.000 habitantes. Con esos datos se calcula una incidencia de 5,46 por 100.000 personas/año (6). Otro estudio, más reciente, presenta dos ventajas sobre el anterior: la primera es que la población de estudio es más grande (600.000 hbts.) y la segunda es que utiliza los criterios diagnósticos de la IASP. Ellos calcularon una incidencia 25,2/100.000 hbts. (5)
Por otra parte, estos estudios muestran otras características de este síndrome y de éstas las fracturas y los esguinces son los eventos más frecuentes. Es más común en miembro superior que miembro inferior; es más frecuente en mujeres que en hombres, con una relación 3:4. La edad de presentación es mayoritariamente entre 50-70 años.
IV. Fisiopatología
Si bien no está claramente establecida la fisiopatología de la enfermedad, podemos mencionar algunas consideraciones fisiopatológicas que sí se conocen.
Inflamación Neurogénica: Existe en estos pacientes liberación de neuropéptidos provenientes de las fibras C nociceptivas, lo cual se ha demostrado por los elevados niveles de Sustancia P, bradiquinina y Péptido-Gen relacionado con Calcitonina (PGRC). Esta respuesta inflamatoria neurogénica podría explicar síntomas comunes del SDRC, como el aumento de temperatura, edema y cambios tróficos de la piel. La liberación de neuropéptidos periféricos podría contribuir también a la hiperhidrosis, un signo clínico que se ve asociado a falla simpática.
Los neuropéptidos son liberados no sólo en la periferia, sino que en las terminaciones de las neuronas primarias aferentes. Después del trauma y lesión del nervio, el receptor de Sustancia P (NK1R) está regulado hacia arriba
en las neuronas del asta dorsal y entonces la SP inicia la sensitización central de las neuronas que trasmiten el dolor para el próximo estímulo nociceptivo. Además, existe sensitización central en la corteza: se ha demostrado con encefalografía magnética que existe una disminución significativa del área de representación de la mano en la corteza primaria sensoria (giro postcentral) del lado afectado. Esta reorganización cortical está relacionada linealmente con la cantidad de dolor en el SDRC, ya que se ha demostrado que ésta se revierte si el dolor se alivia. Estos hallazgos indican que el dolor altera el proceso somatosensorial del cerebro (43, 44).
Se ha demostrado la presencia de FNT alfa en pacientes portadores de SDRC en etapa precoz en la extremidad afectada (63). Además, se ha descrito la mejoría clínica de pacientes con SDRC tratados con dosis bajas de anticuerpo antiFNT alfa (Inflimax) (62).
Entre los otros mecanismos propuestos está uno que tiene relación con hipoxia que produce acidosis por lactato, liberación de radicales libres y protones, lo cual lleva a un desbalance en el equilibrio entre el Óxido Nítrico y la endotelina 1, llevando a vasoconstricción e isquemia, lo que perpetuaría la enfermedad (67).
V. Diagnóstico
El diagnóstico se realiza cumpliendo estos 4 criterios (1):
1. Dolor continuo desproporcionado al evento inicial.
2. Debe presentar al menos un síntoma en 3 de las 4 categorías siguientes:
- Sensitivo: referir hiperestesia y/o alodinia.
- Vasomotor: referir asimetría en la temperatura y/o cambios o asimetrías en el color de la piel.
- Sudomotor/Edema: referir edema y/o cambios o asimetría en la sudoración.
- Motor/Trófico: referir disminución del rango de movimiento y /o disfunción motora (debilidad,
temblor, distonía) y/o cambios tróficos en el pelo, uñas o piel.
3. Debe presentar, al momento de la evaluación, al menos un signo en 2 o más de las siguientes categorías:
- Sensitivo: Evidencia de hiperalgesia y/o alodinia (al tacto suave, a la sensación de temperatura, presión
somática o movimiento articular).
-Vasomotor: Evidencia de asimetría en temperatura
(>1°C) y/o cambios de color o asimetría en la piel.
- Sudomotor/Edema: Evidencia de edema y/o cambios o asimetría en la sudoración.
- Motor/Trófico: Evidencia de disminución del rango de movimiento o disfunción motora (debilidad,
temblor o distonía). Cambios tróficos en uñas, pelo y piel.
4. Ausencia de otro diagnóstico que explique mejor los síntomas y signos.
VI. Diagnóstico Diferencial
Síndromes Neuropáticos Dolorosos:
● Polineuropatía periférica.
● Atrapamiento Nervioso.
● Radiculopatía.
● Neuralgia postherpética.
● Dolor por desaferentación en ACV.
● Plexopatía.
● Enfermedad de la motoneurona.
Enfermedades vasculares
● Trombosis.
● Acrocianosis.
● Aterosclerosis.
● Enfermedad de Raynaud.
● Eritromelalgia.
Inflamación
● Erisipelas.
● Bursitis.
● Artritis Seronegativa.
● Dolor Miofascial.
● “Sobreuso”.
● “Desuso”.
● Codo de tenista.
● Fibromialgia.
● Enfermedad Psiquiátrica.
● Desórdenes de dolor somatomorfo.
VII. Tratamiento Conservador
Terapia farmacológica
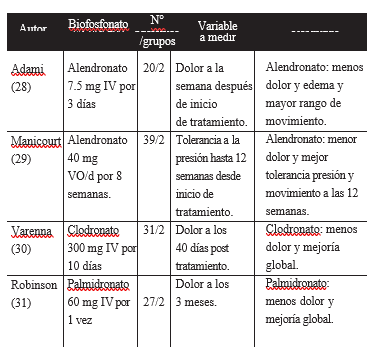
1. Biofosfonatos
Existen 4 estudios randomizados controlados que evalúan el efecto de diferentes biofosnatos en pacientes con SDRC y en todos ellos se ha demostrado beneficio tanto en la disminución del dolor como en el grado de edema y rango de movimiento. Sin embargo, sólo en dos de ellos se utilizó la definición de SDRC de la IASP y sólo en uno se justificó el tamaño de la muestra. (28, 29, 30, 31).
El mecanismo de acción a través del cual los biofosfatos producen beneficio en el SDRC es desconocido. Se sabe que disminuyen la aceleración local del remodelamiento óseo y se presume que el efecto analgésico es en las fibras primarias aferentes nociceptivas óseas (64).
2. Antirradicales Libres
Se ha evaluado el uso de dimetilsulfoxido al 50% (DMSO), N Acetilcisteína (NAC) y manitol con resultados parciales. En general, el DMSO muestra una mejoría leve en dolor, edema y rango de movimiento cuando se comparó con placebo (32, 45). No existieron grandes diferencias entre NAC y DMSO (34). Manitol no mostró beneficios en comparación a placebo (35).
3. Vitamina C
Se ha demostrado la utilidad de la vitamina C en la prevención del SDRC en pacientes con fractura en varios estudios (64). El último, publicado en 2007, es un estudio prospectivo, randomizado, doble ciego y multicéntrico, en el cual se reclutaron 416 pacientes con fracturas y se administró vitamina C (en diferentes dosis) o placebo por vía oral por 50 días. La prevalencia de SDRC en el grupo de Vitamina C fue de 2,4% (8 de 328 pacientes) y 10,1% (10 de 99 pacientes) en el grupo Placebo. La dosis recomendada es de 500 mg/d. (66).
4. Esteroides
Los corticoides tienen múltiples efectos, entre ellos, son capaces de inhibir la producción de mediadores inflamatorios, reducen la tasa de transcripción en las células ganglionares de la raíz dorsal y, por lo tanto, reducen el contenido de sustancia P en las neuronas sensoriales, y también facilitan la degradación de neuropéptidos. Dado lo anterior, el desarrollo de inflamación neurogénica y el dolor neuropático pueden ser prevenidos (42).
Existen 2 estudios randomizados controlados en que se comparan esteroides con placebo en pacientes con SDRC. El primero es con prednisona (10 mg c/ 8 hrs VO) en que se mantuvo el tratamiento hasta observar resultados o como máximo 12 semanas. Se observó un 75% de mejoría (dolor, edema y función motora) v/s 20% en el grupo placebo (46). Otro estudio en que se utilizó metilprednisolona y placebo por 4 semanas, se observó mejoría, luego cruzaron los grupos y el grupo corticoide mostró permanencia de los beneficios, los cuales se mantuvieron hasta 6 meses (47). Sin embargo, dado que el uso de corticoides produce potenciales complicaciones serias, su uso a largo plazo no está recomendado (15).
5. Neuromoduladores
Los antidepresivos triciclos (como la amitriptilina e imipramina) son los fármacos de primera línea para el dolor neuropático, ya que cuentan con la mejor evidencia para este tipo de dolor, sin embargo, no se encontraron estudios que evalúen su rendimiento específicamente en pacientes con SDRC.
Carbamazepina: Un estudio randomizado controlado muestra que carbamazepina en una dosis de 600 mg/d reduce significativamente el dolor neuropático cuando se la compara con placebo (36).
Gabapentina: Se realizó un estudio controlado doble ciego y cruzado con un periodo de “washout” de 2 semanas, en el cual no se encontraron diferencias significativas entre gabapentina y placebo. Sólo se apreció mejoría en el Efecto Global Percibido (EGP). También se observaron más efectos adversos en el grupo gabapentina (37).
6. Vasodilatadores
Tadalafil: Un estudio compara tadalafil con placebo en pacientes portadores SDRC frío y se evalúa cambio de temperatura del miembro afectado en relación al sano como variable principal. No se encontraron diferencias en el cambio de temperatura ni en la función motora. Sin embargo, el grupo tratado con tadalafil mostró una reducción del dolor mayor que el placebo (48).
Se han probado bloqueadores alfa 1 adrenérgicos (fenoxibenzamina o terazosina, ketanserina), incluso con bloqueadores de canales de calcio, como el nifedipino o verapamil, pero no existe evidencia de buena calidad para SDRC (15).
7. Espasmolíticos
Dado que la alteración en la función motora se puede presentar también con distonía, temblor o mioclonías, parece razonable usar en estos pacientes baclofeno oral, benzodiazepinas u otro espamolíticos (15). No se ha reportado evidencia de su utilidad en SDRC.
Terapia Física
Existe una revisión sistemática que evalúa el rol de la Terapia Física en el SDRC, la cual demuestra que existe evidencia de buena calidad para afirmar que la Terapia Física, principalmente en forma de Imagenería Motora Graduada (movimientos imaginarios de la mano y terapia en espejo, donde se van ejecutando movimientos progresivos en ambos brazos mirando el brazo sano, en lugar del enfermo) es efectiva en reducir el dolor en una cantidad clínicamente relevante en el SDRC y este beneficio se mantiene por lo menos 6 meses (50), todo lo cual es ratificado en otras revisiones (49, 51).
Por lo tanto, la terapia física es parte del tratamiento primario con movilización activa temprana, combinada con fármacos analgésicos y otros orientados según los síntomas del paciente (16).
VIII. Tratamiento Intervencional
1. Ketamina Endovenosa (EV) en dosis subanestésicas: Contamos con 3 estudios randomizados, controlados que evalúan el efecto de la ketamina EV, en dosis subanestésicas, en pacientes con SDRC.
El primer trabajo, prospectivo, publicado en 2009, describe pacientes ambulatorios con SDRC en quienes en un periodo de 10 días se administró ketamina IV por 4 hrs con una dosis máxima de 0,35 mg/Kg/hr. v/s placebo, resultando en una clara disminución del dolor en los pacientes del grupo ketamina con un seguimiento de hasta 3 meses (39). El otro estudio, también prospectivo, presenta 30 pacientes por grupo, con ketamina en infusión por 4 días y un promedio de dosis de 0,31 mg/kg/hr, con resultados positivos para el grupo ketamina, en la disminución del dolor en un plazo de 12 semanas. No encontraron mejorías en el aspecto funcional (40). El último trabajo es retrospectivo, en pacientes hospitalizados. También muestra un efecto positivo de la ketamina en la analgesia de estos pacientes (38).
2. Bloqueo Regional Endovenoso (REV)
Se han usado diversas drogas simpaticolíticas en el bloqueo
REV, con resultados variados y en general poco alentadores.
Guanetidina
En general, los estudios randomizados controlados han demostrado que no hay beneficios cuando se compara con placebo y sí, aparecen efectos adversos como mayor sensibilidad a los cambios de temperatura y alteraciones en el color de la piel (7, 8, 9).
Existe un estudio en que se demuestra el beneficio de la guanetidina en REV, sin embargo, este resultado se obtuvo de una serie de casos en que se administraron 25 bloqueos durante 11 semanas (10), lo cual en la práctica clínica resulta poco costo-efectivo.
Se han usado otros agentes como ketanserina, atropina, droperidol, metilprednisonola, sin resultados positivos (11, 12). Se ha visto que el bretilio prolonga el efecto analgésico de los anestésicos locales en REV en pacientes con SDRC (15).
Clonidina
Se ha visto que pacientes que tienen historia de SDRC y que se van operar de la misma extremidad, si se les administra anestesia regional EV con lidocaína más clonidina, la tasa recurrencia de SDRC es notoriamente inferior que de los pacientes que no recibieron clonidina en la anestesia (10% v/s 74%) (14), lo que sugiere un importante rol en la prevención de este síndrome.
3. Bloqueo de Ganglio Estrellado (GE) y Simpático Lumbar (SL) con Anestésico Local (AL).
Su utilidad está documentada en estudios retrospectivos y prospectivos (16).
A continuación, se describen los principales hallazgos de los estudios que evalúan el Bloqueo de GE con AL.
El primer estudio consiste en 28 pacientes tratados mediante un catéter instalado en la zona del GE, con inyección de bupivacaína 0,5% 4 veces al día por 7 días. Se realizó seguimiento desde 6 meses hasta 6 años. Un 70% de los pacientes expresaron que el dolor había mejorado bastante y alrededor de un 25% expresó que la mejoría a largo plazo fue mínima (52).
Otro estudio realizado a largo plazo con inyecciones intermitentes de bupivacaína más terapia conservadora (analgesia, terapia física, ansiolíticos) mostró un 75% de clara mejoría y un 25% de recaída a los 3 años de seguimiento (53).
El último, realizado en el 2006, también muestra beneficio en analgesia, sin embargo, mostró una disminución en la perfusión de la piel del miembro afectado comparado con el lado sano (54).
Bloqueo de GE y SL
En un estudio, se realizaron inyecciones semanales de AL (14-16 ml bupivacaína 0,25%) o bupivacaína 0,25% continua a 5 ml/hrs por 5 días en GE y SL. Se vio una disminución significativa de la escala de EVA (47%) y mejoría en la funcionalidad que duró en promedio 9 meses (18). Se observó que una mejoría mayor al 50% después del bloqueo diagnóstico se correlacionaba directamente con la mejoría a largo plazo.
Se ha visto que comparado con placebo, el AL prolonga el efecto analgésico, sin afectar el efecto peak de la analgesia (en promedio 5 días v/s 6 hrs) (17).
Bloqueos Simpático Lumbar con AL más Toxina Botulínica Un estudio controlado randomizado de 9 pacientes con SDRC de más de 6 meses de evolución, comparó bloqueos simpático lumbar con bupivacaína v/s el mismo AL más toxina botulínica A y se encontró que la toxina aumenta significativamente la duración de la analgesia (10 días v/s 71 días) (19). Una explicación puede ser que la toxina previene la liberación de ACh de los nervios simpáticos preganglionares, entonces induce a un bloqueo prolongado y no permanente (16).
Simpaticolisis química con fenol 7% y Simpatectomía con Radiofrecuencia (RF)
Ganglio estrellado
La ablación con RF fue comparable a otros métodos de bloqueo. El 40% de los pacientes presentaron más de un 50% de alivio del dolor (grupo de pacientes que respondieron en forma positiva al bloqueo diagnóstico) (20).
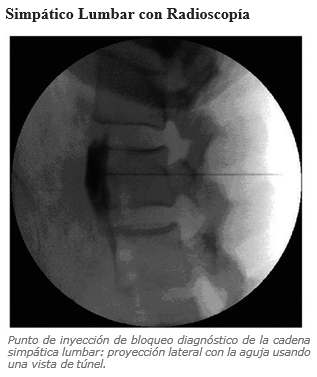
Simpático Lumbar
En una serie de 20 pacientes con CRPS se realizó RF en los ganglios simpáticos entre L2 y L4. 5 pacientes obtuvieron alivio completo del dolor (25%) y 9 alivio temporal (45%) (21). Al comparar RF con simpaticolisis con fenol en SL se encontró que el efecto simpaticolítico a las 8 semanas estaba presente en casi el 90% de los pacientes v/s el 12% de ellos con RF y no se encontraron diferencias en la presencia de neuralgia postsimpatectomía (22). En otro estudio, realizado en 2008, de 20 pacientes con SDRC en miembro inferior en el que también se comparó RF con neurolisis con fenol (3ml de fenol al 7% por nivel) los pacientes presentaron disminución significativa del dolor sin diferencias entre los 2 grupos hasta 4 meses de seguimiento. Un paciente del grupo fenol presentó síntomas de dolor neuropático (23).
Ganglio Estrellado con Tadioscopia
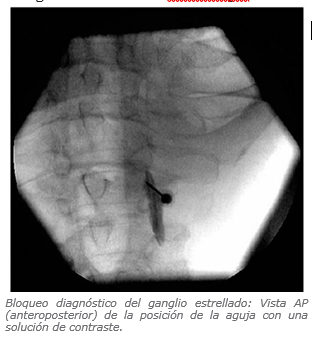
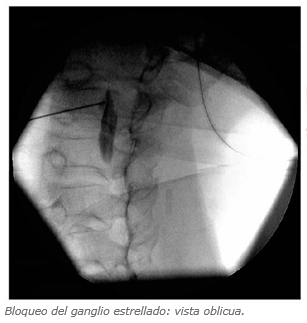
Complicaciones de Bloqueos Simpáticos
Bloqueo de Ganglio Estrellado
Se calcula una incidencia de 1 en 1000 (16). Existe la posibilidad de realizar una inyección inadvertida subaracnoídea o en la arteria vertebral, lo cual puede ser potencialmente fatal.
Otras complicaciones relacionadas con la punción de estructuras cercanas, como por ejemplo: punción de la cavidad pleural o punción esofágica.
Efectos secundarios: Síndrome de Horner y ronquera por bloqueo del nervio laríngeo (16).
Complicaciones del Bloqueo Simpático Lumbar
Daño al Nervio Genitofemoral (5-10%) y al N. Ilioinguinal (56).
Dolor neuropático por desaferentación.
Impotencia si es que se realiza en bloqueo bilateral con químicos.
Efectos secundarios: Hipotensión.
Conclusión de los Bloqueos Simpáticos
El Bloqueo de GE mediante inyecciones intermitentes de AL está documentado en estudios retrospectivos y prospectivos (16).
La RF para GE sólo en estudios retrospectivos (16).
El Bloqueo de SL con AL ha demostrado ser superior a placebo.
La RF y neurolisis con fenol tienen efectos comparables en el SL. Si bien la neurolisis ha demostrado tener efecto en la simpaticólisis más prolongado, la probabilidad de dolor por desaferentación es mayor y, por lo tanto, se recomienda la RF (16).
4. Bloqueos Somáticos: De Plexo y Neuroaxiales
Bloqueo de Plexo Braquial.
No existen estudios prospectivos específicos para SDRC y bloqueo de plexo braquial.
Un estudio retrospectivo reclutó 25 pacientes de los cuales 17 tenían SDRC, a los cuales se les había realizado bloqueo interescalénico con 30 a 40 ml. de bupivacaína 0,125% con un total de 10 inyecciones; se observó mejoría tanto en dolor como en rango de movimiento (57).
Administración de Drogas Epidural
Existe un trabajo en que estudia pacientes con SDRC de rodilla a quienes, a través de un catéter peridural, se les administró AL por 2 ó 3 días, seguido de opiodes por 7 días más movilización pasiva y mostraron clara mejoría en la función de la rodilla (58).
Peridural cervical lateralizado
En el año 2002, se publicó un estudio retrospectivo con 37 pacientes portadores de SDRC, a quienes se instaló catéter peridural por donde se administró bupivacaína más fentanilo, quienes obtuvieron un 90% de mejoría. Sin embargo, este resultado se obtenía sólo si es que
el tratamiento se comenzaba durante el primer año de inicio de los síntomas (59).
Clonidina Epidural
Existe un estudio RC, publicado en 1993, en el cual se reclutaron 26 pacientes con SDRC refractarios a bloqueos simpáticos. Se les instaló catéteres epidurales cervical (C7-T1) y lumbar (L2-L3), y se administró distintas dosis de clonidina (300 y 700 microgramos) y suero fisiológico, por 3 días consecutivos. Se encontró una gran disminución del dolor en los grupos con clonidina, en comparación al grupo placebo y sin diferencia analgésica entre las dos dosis de clonidina. Existió más sedación en el grupo que se usó 700 microgramos de clonidina epidural (24).
Baclofeno Intratecal
Pacientes con SDRC asociado a distonía han mostrado alivio significativo de la distonía, también mejoría en el dolor y calidad de vida, sin embargo presentan una tasa de complicaciones alta (60, 61).
5. Estimulación Medular
Un electrodo es posicionado en el espacio epidural, en el aspecto dorsal de la médula espinal a nivel de la raíz nerviosa que inerva el área dolorosa, la corriente que emite el electrodo origina una parestesia; una sensación que suprime el dolor.
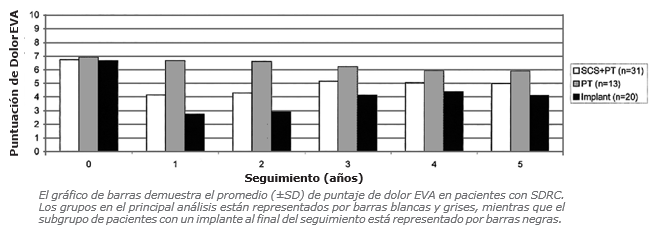
Existe un estudio Randomizado Controlado que es único en su tipo (25, 26), ya que presenta el seguimiento a largo plazo (5 años) de pacientes con CRPS y Estimulación Medular.
Se reclutaron 54 pacientes para una randomización 2:1, de tal manera que 36 pacientes fueron al grupo Estimulador Medular (EM) más Fisioterapia (FT) y 18 sólo con FT. Se instaló el Estimulador Permanente en 24, que fueron los tuvieron el test de estimulación de prueba positivo.
Se midió:
EVA, Efecto Percibido Global (EPG), que es una escala de 7 puntos donde 1 es lo peor del mundo y 7 lo mejor; satisfacción del tratamiento e índice de calidad de vida relacionado con la salud.
Los pacientes fueron evaluados antes de la randomización, antes de la instalación del estimulador, luego cada año por 5 años.
Sus resultados fueron:
1. Durante los 2 primeros años existió una clara disminución del dolor en el grupo EM y también el EGP.
2. A los 5 años el grupo EM presentó resultados similares al grupo de sólo FT, en todas las variables medidas. Sin embargo, en el análisis de subgrupo los pacientes que recibieron el implante presentaron alivio del dolor y EGP mayor que los tratados sólo con FT.
3. El EM no afectó los índices de calidad de vida.
Complicaciones:
Al cabo de 2 años de tratamiento, 9 de los 24 pacientes (38%) requirió reoperación por complicaciones.
Durante los años 3, 4 y 5 se requirió reintervención en 4
de los 20 pacientes. Finalmente, a los 5 años, 10 de los 24 pacientes (42%) requirieron reoperación por complicaciones. 72% de los eventos adversos ocurrió durante los dos primeros años.
Las complicaciones más comunes fueron:
1. Falla en el generador de pulso.
2. Desplazamiento del cable.
3. Necesidad de revisión del paquete generador de pulso. Finalmente los autores concluyen que:
1. Existe una clara disminución del dolor en los 2 primeros años y un análisis de costo-efectividad positivo.
2. A partir del tercer año, las diferencias en alivio de dolor disminuyen. Sin embargo, los indicadores de satisfacción se mantienen altos, llegando a un 95% de los pacientes que recibieron el estimulador permanente repetiría el tratamiento con el mismo resultado.
3. Presenta una alta tasa de complicaciones.
Recomendaciones de WIP (16)
Las recomendaciones de WIP para el manejo de los pacientes con SDRC están basadas en una categorización en que la fuerza de la recomendación depende de la calidad de la evidencia que existe para el tratamiento de este síndrome, y son las siguientes:
1. Contar con un diagnóstico basado en los criterios del último consenso de IASP, es decir, descartando dirigidamente otras causas que puedan explicar los síntomas del paciente. El tratamiento conservador tiene dos pilares: la terapia física, que debe iniciarse precozmente; y el tratamiento farmacológico debe estar dirigido según el mecanismo predominante de los síntomas del paciente.
2. Si el paciente recibe un adecuado tratamiento conservador y a pesar de ello persiste con EVA mayor 4, debe iniciarse apoyo psicológico y el tratamiento intervencional.
3. Bloqueo diagnóstico de tronco simpático: Ganglio estrellado o simpático lumbar, si el resultado es positivo, se puede programar realizar bloqueos seriados o bien ablación con radiofrecuencia. Si el bloqueo no tiene efecto deseado, se pueden realizar bloqueos somáticos (plexo braquial o instalación de catéter neuroaxial). Esto último cuenta con una fuerza de recomendación menor.
4. Si el resultado es negativo, se sugiere hacer un test de estimulación medular.
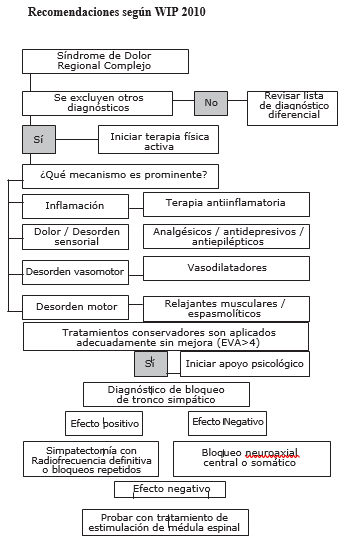
Si integramos el esquema propuesto por la WIP y la evidencia recogida en esta revisión, podemos sugerir lo siguiente.
Primero establecer claramente el diagnóstico.
Iniciar el manejo conservador con fármacos orientados, según los síntomas predominantes, con énfasis en una buena terapia analgésica que permita iniciar la terapia física en forma adecuada y precoz.
Terapia Antiinflamatoria: corticoides orales son una alternativa razonable si se usan por periodos de tiempo no prolongados (menos de 12 semanas) para disminuir los síntomas inflamatorios. Terapia analgésica: los biofosfonatos, en administración oral o endovenoso, cuentan con buena evidencia en su rol analgésico, además de la disminución del edema y la disfunción motora. Los antirradicales libres, como el Dimetilsulfóxido en crema, han mostrado utilidad.
Tratamiento de los síntomas neuropáticos: a pesar de no contar con evidencia específica para SDRC, los antidepresivos tricíclicos siguen siendo los que cuentan con mejor evidencia para el dolor neuropático en general. La carbamazepina es también una opción para estos pacientes. La gabapentina no cuenta con evidencia favorable.
Tratamiento de los síntomas vasomotores: se cuenta sólo con estudios con tadalafil, el cual no demostró mejoría en esos síntomas pero sí un efecto analgésico.
Tratamiento de la disfunción motora: no se encontraron trabajos que evaluaran efecto de relajantes musculares en pacientes con SDRC. Sin embargo, sí está demostrado un efecto positivo del baclofeno intratecal en pacientes con distonía severa.
En relación al manejo intervencional, el uso de ketamina endovenosa en dosis subanestésicas cuenta con buena evidencia en el manejo de la analgesia de estos pacientes. Y su uso podría estar recomendado en un paso anterior al intervencional.
Los bloqueos de tronco simpático deben hacerse idealmente mediante la instalación de catéter para inyecciones seriadas o infusión continua, ya que la evidencia que existe es principalmente con esta modalidad.
En el caso de que los bloqueos simpáticos no funcionen los bloqueos somáticos tendrían indicación.
Es destacable el rol de la clonidina epidural, tanto en la prevención como en el tratamiento de estos pacientes.
Finalmente, sólo en el caso de falta de respuesta a todo lo anterior, estaría indicado realizar un test de estimulación medular.
Consideramos importante mencionar el concepto de la prevención de SDRC, ya que existen fármacos que han demostrado clara utilidad en ese sentido:
La Vitamina C en administración oral en pacientes con fractura (500 mg/d por 50 días) y clonidina en anestesia regional endovenosa para pacientes que van a ser sometidos a cirugía del mismo miembro que ha padecido la enfermedad.
Conclusiones:
• El SDRC es una enfermedad crónica que puede ser muy limitante y tanto su fisiopatología como su tratamiento están aún en investigación.
• El diagnostico y respuesta a tratamiento están poco estandarizados,
por lo que es difícil disponer de evidencia de buena calidad.
• El tratamiento debe estar enfocado en el paciente individual, ser
escalonado y multidisciplinario.
• El tratamiento conservador es la primera línea con la Terapia
Física, que tiene un rol basal en el manejo de estos pacientes y es
una de las pocas modalidades de manejo que cuenta con evidencia de buena calidad. Y la terapia farmacológica, que debe estar orientada de acuerdo a los síntomas del paciente.
• El tratamiento intervencional debe iniciarse sólo si no existe respuesta a un adecuado manejo conservador, ya que tienen complicaciones y hasta ahora una evidencia en general débil.
Futuro:
• Concepto de prevención de SDRC.
• Esperamos nuevos estudios con criterios diagnósticos y outcomes estandarizados, con el fin de mejorar el nivel de evidencia actual.
• El nuevo rol de técnicas intervencionales con Ultrasonido.
• Investigación de mediadores inmunes (FNT alfa).






