Etiquetas
#pandemia #COVID-19 #triaje #toma de decisiones #comorbilidades #cuidados paliativos #Dolor crónico #Neurocirugía #Síndrome de Fracaso de Cirugía Espinal Lumbar #anestesia espinal unilateral #dosis mínima #lateralización #cirugía traumatológica ambulatoria #nervio pudendo #neuralgia #radiofrecuencia pulsada; ultrasonido. #dolor #dolor neuropatico #topiramato #dolor agudo postquirúrgico #dolor incisiona #anestesia #niños #dolor agudo #dolor quirurgico #modelos y teorias #enfermeria #noticias #Investigación en Servicios de Salud #Rehabilitación #ansiedad #emociones #miedo #tristeza #Parche #Buprenorfina #Fentanilo #problemas sociales #síndrome pediátrico inflamatorio multisistémico #fibromialgia #narrativas #experiencia #Afrontamiento #estados emocionales #dolor de espalda #Cuidado paliativo #opioidesRevista El Dolor 77 | Noviembre 2024 - Año 34 | Originales
Manejo Intervencional del dolor pélvico de origen oncológico. Propuesta
Aceptado: 21-08-2023
Páginas 24-33
Cárcamo, César(1)
(1) Unidad de Cuidados Paliativos y Dolor Hospital del Salvador, Clínica Santa María y Clínica Dávila.
Resumen
El dolor oncológico severo ocurre hasta en el 60% de los pacientes con cáncer pélvico, siendo refractario al tratamiento médico hasta en el 30% de los casos. Las presentaciones pueden incluir un síndrome de dolor visceral pélvico, una plexopatía lumbosacra maligna, dolor por metástasis óseas sacroilíacas y dolor pélvico posquirúrgico crónico. Se han desarrollado terapias intervencionales mínimamente invasivas para tratar el dolor, que en etapas tempranas en pacientes con dolor no controlado mejoran su condición de salud, mejoran su rendimiento para enfrentar la enfermedad y su tratamiento, y evitan o retrasan la escalada de opioides con sus efectos adversos asociados. Se requiere estandarizar las técnicas, mejorar la calidad de los ensayos clínicos y desarrollar guías de práctica clínica en un trabajo conjunto con oncología.
Palabras clave: dolor pélvico; dolor por cáncer; técnicas ablativas; bloqueo neurolítico; neurectomía; denervación.
Abstract
Severe cancer pain occurs in up to 60% of patients with abdominopelvic cancer, being refractory to medical management in up to 30% of cases. Presentations may include pelvic visceral pain syndromes, malignant lumbosacral plexopathy, sacroiliac bone metastasis pain, and chronic pelvic post-surgical pain. Minimally invasive interventional therapies have been developed to treat pain, which in early stages in patients with uncontrolled pain improve their health condition, improve their performance in coping with the disease and its treatment, and prevent or delay the escalation of opioids with their associated side effects. It is necessary to standardize the techniques, improve the quality of clinical trials and develop clinical practice guidelines in a joint effort with oncology.
Key words: pelvic pain; cancer pain; ablation techniques; neurolytic block; neurectomy; denervation.
Introducción
La pelvis contiene múltiples estructuras ricamente inervadas que son fuentes potenciales de dolor. El dolor pélvico de origen oncológico es una condición clínica relacionada con el compromiso de vísceras por el tumor, la estructura musculoesquelética pélvica, las raíces neurales o plexos debidos a tumores primarios o metástasis o a conglomerados ganglionares que causan efecto de masa. Además, el dolor también puede ser consecuencia de los tratamientos instaurados, por ejemplo, la quimioterapia, la radioterapia y la cirugía. El dolor oncológico pélvico por cáncer puede ser visceral (infiltración de órganos), somático (infiltración ósea pélvica), o neuropático (infiltración tumoral o compresión de los nervios). Alrededor del 75% de los pacientes presentarán dolor en cualquier momento durante la enfermedad, y 50% y 30% tendrán dolor moderado-severo y muy severo, respectivamente.
El dolor pélvico oncológico se puede controlar mediante diferentes terapias intervencionales, dependiendo de la edad del paciente, el tiempo de sobrevida esperado, y la disponibilidad de terapias invasivas y no invasivas según la ubicación del tumor y las vías del dolor. Las terapias intervencionales neuroablativas o neurolíticas se refieren a la lesión de un nervio o plexos nerviosos con la intención de reducir el dolor con productos químicos (alcohol o fenol), o temperatura (crioablación o termocoagulación). Aunque son efectivas, estas terapias intervencionales presentan potenciales riesgos, tales como una lesión neurológica excesiva (neuritis), daño a tejidos no neurales o alivio parcial o incompleto debido a infiltración tumoral o tejido cicatricial.
Con la finalidad de estandarizar las terapias intervencionales para el control del dolor pélvico de origen oncológico, he clasificado los distintos síndromes de dolor pélvico oncológico en 4 grandes grupos.
Tabla 1
Manejo Intervencional del dolor visceral pelviano
Neurólisis del plexo hipogástrico superior
La Neurolisis del plexo hipogástrico superior es una terapia intervencional que puede reducir eficazmente el dolor debido a cánceres de vísceras pelvianas. Los pacientes con dolor pélvico severo, no controlados con analgésicos orales o con efectos secundarios relacionados con la medicación, con una esperanza de vida de menos de 6 meses, son los candidatos ideales para esta Neurolisis.
El plexo hipogástrico superior es una estructura preaórtica retroperitoneal, localizada a nivel del promontorio sacro entre los dos tercios inferiores del cuerpo vertebral L5 y el tercio superior del cuerpo vertebral S1. Está justo debajo de la bifurcación de la aorta, cerca de los vasos ilíacos y el uréter en un patrón en forma de abanico. El plexo está formado por dos raíces laterales y una raíz medial (1). Las raíces laterales se originan principalmente en los nervios esplácnicos lumbares más bajos y contienen un componente simpático, mientras que la raíz medial es una continuación del plexo aórtico abdominal desde el plexo mesentérico inferior y tiene componentes simpáticos y parasimpáticos (2). Por lo tanto, es un plexo predominantemente simpático de los tractos aferentes que inervan los órganos pélvicos.
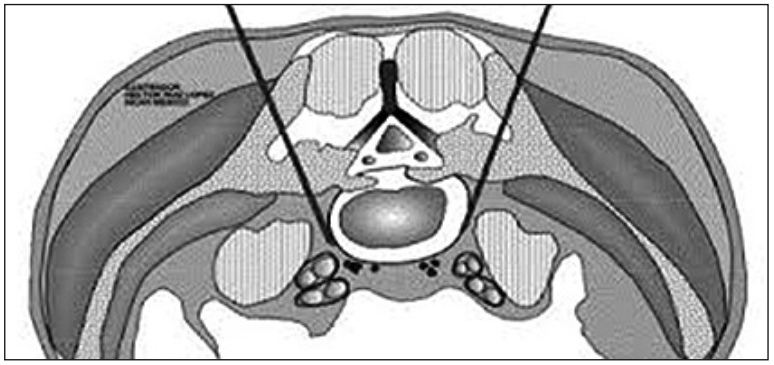
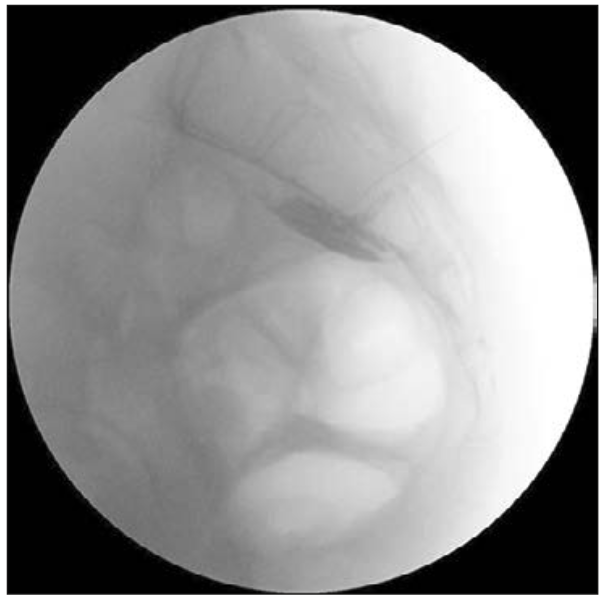
El abordaje percutáneo del plexo hipogástrico superior fue inicialmente descrito por Plancarte et al (3) en 1990 para el tratamiento de dolor de cáncer pélvico. La técnica descrita consiste en dos agujas (15 cm, 20G) que se avanzan bilateralmente vía posterior, 6 cm lateral a la línea media a nivel de la vértebra L5, siendo el objetivo alcanzar la superficie anterolateral de la unión L5-S1 (Figura 1).
Neurólisis plexo hipogástrico superior
Figura 1. Neurólisis plexo hipogástrico superior por vía posterior: se observan agujas que alcanzan borde anterior de L5 (3).
En un gran ensayo de 227 pacientes con dolor pélvico secundario a cáncer ginecológico, colorrectal o genitourinario, el 79 % tuvo una respuesta positiva a un bloqueo diagnóstico del plexo hipogástrico superior, y un 72% reportó alivio efectivo del dolor y reducción significativa en el consumo de opioides después de la Neurolisis (4). A los 6 meses de seguimiento, el 69% de los pacientes mantenían el alivio del dolor continuo junto con una reducción del 67% en el consumo de opioides.
Un metaanálisis reciente (5) de la técnica reportada por Plancarte encontró ocho estudios que cumplieron los criterios de inclusión, 6 fueron longitudinales descriptivos y 2 ensayos clínicos controlados, con un total de 316 pacientes, 75% femenino y 25% masculino; edad promedio 53,2 años; diagnóstico más frecuente: Cáncer ginecológico (65%). Se logró una reducción de la escala visual análoga (EVA) de un 55%-60,8% y reducción de la dosis equivalente de miligramos de morfina oral día entre un 40%-60%. Tres estudios evaluaron la calidad de vida mostrando mejoría en todas. Se reportaron complicaciones en 18% de los casos, siendo el dolor en el sitio de punción la más frecuente.
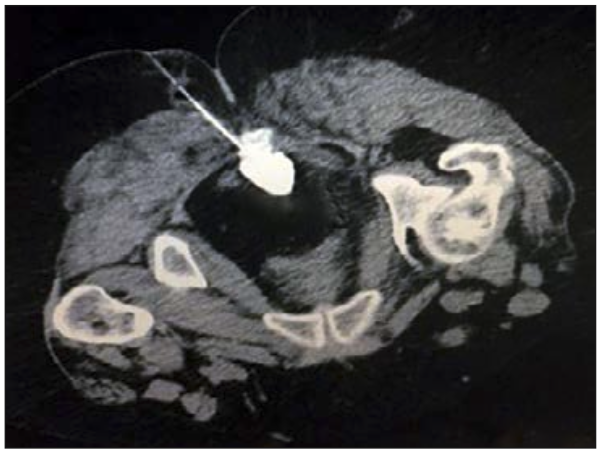
Hay varios problemas técnicos en la realización de la Neurolisis del plexo hipogástrico por la vía posterior, como la presencia de una cresta ilíaca grande y/o una apófisis transversa de L5 que puedenobstruireltrayectodelasagujas.Variasmodificacionesa la técnica han sido propuestas por distintos autores para superar estas dificultades, como la técnica guiada por Tomografía Axial Computada (TAC) (6), el abordaje transdiscal (7,8), el abordaje transvascular (9), el abordaje transvaginal (10), el abordaje lateral (11), y abordaje anterior transabdominal (12).
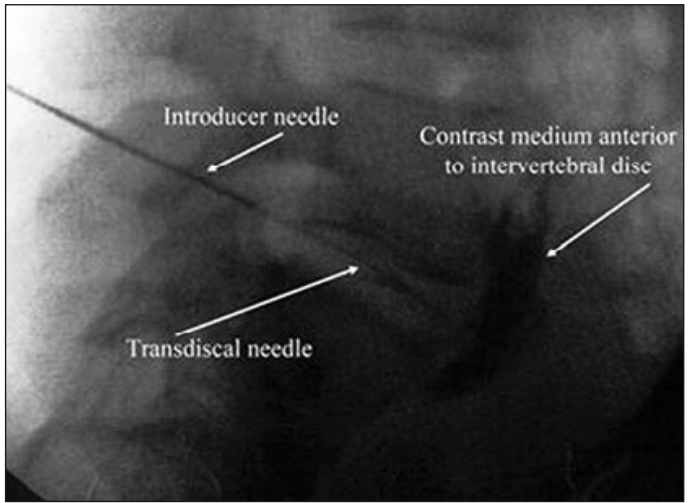
Acceso plexo hipogástrico superior vía transdiscal
Figura 2. Acceso plexo hipogástrico superior vía transdiscal: se observa en la figura trayecto transdiscal de la aguja y difusión sobre promontorio sacro del medio de contraste (7).
Gamal et al (7) comparó la técnica clásica versus la técnica transdiscal con una aguja y encontró una mayor efectividad (100% versus 86%) y menor porcentaje de complicaciones en el acceso transdiscal (Figura 2). Pero, a pesar de ser una técnica fácil, existe la posibilidad de complicaciones graves, como infección o ruptura del disco intervertebral, o lesión de la cauda equina (13).
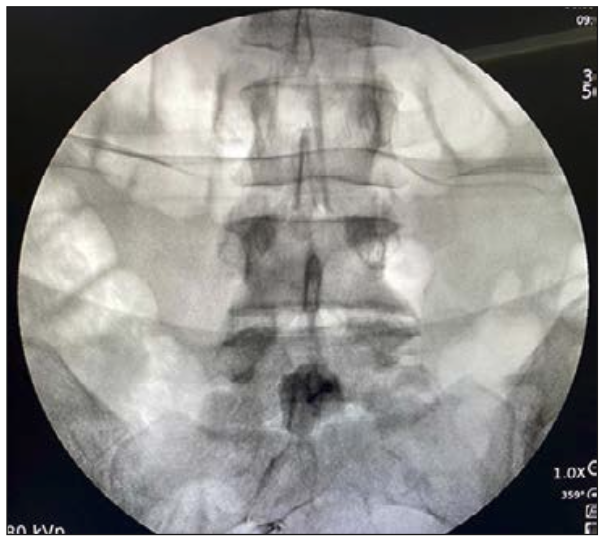
Kanazi et al (12) describieron la vía anterior transabdominal para la Neurolisis del plexo hipogástrico superior. Se debe realizar con una aguja pequeña 21 G, con cobertura antibiótica, preparación de colon y precaución con los grandes vasos iliacos (Figuras 3 y 4).
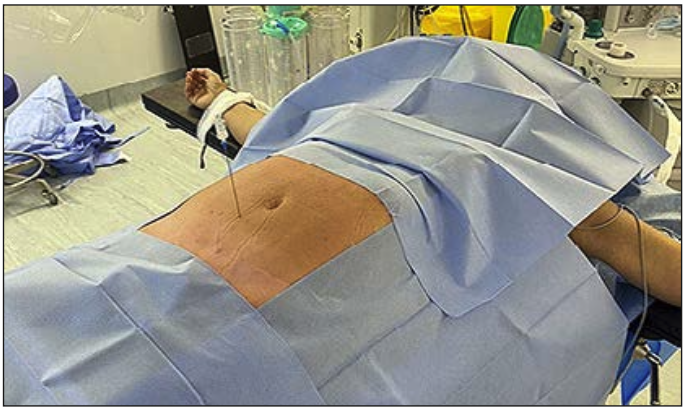
Abordaje anterior transabdominal del plexo hipogástrico superior
Figura 3: Abordaje anterior transabdominal del plexo hipogástrico superior: se observa la inserción transabdominal de la aguja.
Abordaje anterior transabdominal del plexo hipogástrico superior
Figura 4: Abordaje anterior transabdominal del plexo hipogástrico superior: se observa difusión del medio de contraste sobre promontorio sacro.
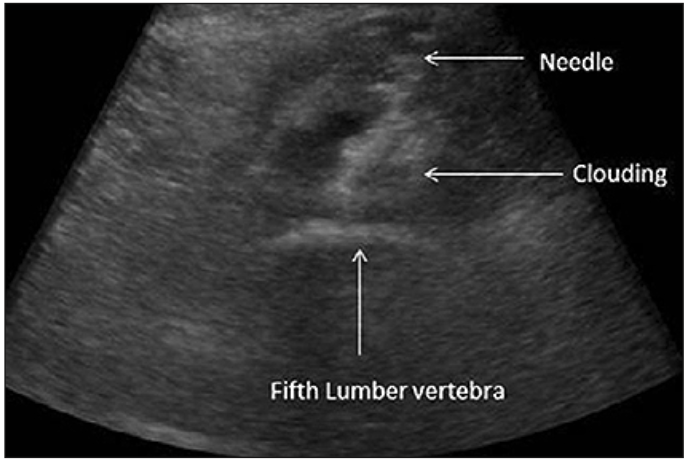
Mishra et al describen el abordaje anterior transabdominal del plexo hipogástrico superior vía ecografía (14). El autor realiza esa técnica de abordaje anterior bajo ecografía, pero con avance de la aguja en plano (Figura 5). Tiene las ventajas sobre el abordaje posterior que permite realizarlo en pacientes que no toleran la posición prona o la anestesia general, ya que puede ser realizado bajo anestesia local.
Abordaje anterior transabdominal del plexo hipogástrico superior
Figura 5: Abordaje plexo hipogástrico superior vía anterior transabdominal bajo visión ecográfica: se observa trayectoria de aguja que alcanza plano óseo vértebra L5 y la imagen de distribución del líquido que se describe como una nube (14).
En un segundo estudio Mishra et al comparó dos grupos de pacientes con cáncer ginecológico pelviano avanzado y dolor pélvico severo no controlado con opiáceos (15). En 25 pacientes se mantuvo esquema farmacológico y en otros 25 pacientes se realizó Neurolisis plexo hipogástrico superior vía anterior transabdominal bajo ecografía. Bajo visión ecográfica identifica la división de los vasos iliacos y avanza trocar 22 G fuera de plano hasta contactar plano óseo. Se retira 2 mm y, previa aspiración negativa para sangre, inyecta 10 ml alcohol al 50% con bupivacaina 0,25%. El EVA disminuyó desde 7/10 a 2/10 y se mantuvo en EVA 2/10 durante 2 meses y al tercer mes el EVA era 3/10, siendo la disminución mayor que con la farmacoterapia sola. El 24% del grupo con farmacoterapia presentó constipación comparado con el 4% del grupo de la Neurolisis. El grupo con Neurolisis presentó un 8% de diarrea transitoria debido al desbalance parasimpático post bloqueo.
Abdelghaffar et al (16) compararon las técnicas de Neurolisis vía anterior transabdominal guiadas por fluoroscopia o por ecografía. Ambas fueron similares en disminuir el EVA y el consumo de opiáceos, pero la técnica fluoroscópica fue levemente más corta de duración y mejor evaluada por el paciente. Como los pacientes estaban despiertos, probablemente la compresión abdominal que requiere la visión ecográfica explicaría la diferencia.
Respecto del momento de indicar la terapia intervencional para el control del dolor severo, Amr et al (17) compararon un bloqueo simpático temprano versus un bloqueo tardío en 109 pacientes con dolor oncológico secundario a cáncer abdominal y/o pélvico, encontrando una mayor efectividad del bloqueo temprano en el manejo del dolor con una disminución significativa del EVA, del consumo de opiáceos y una mejoría de la calidad de vida en los primeros 12 meses de seguimiento. La explicación de estos resultados radicaría en que, a medida que avanza la enfermedad, las masas tumorales pueden obstruir el plexo hipogástrico impidiendo su bloqueo efectivo.
Además, dado que la progresión de la masa tumoral puede infiltrar otros tejidos inervados por nervios somáticos, y como el bloqueo hipogástrico superior solo cubre fibras simpáticas, su efecto puede no ser efectivo en el tiempo por la aparición de dolor abdominopelviano en otros sitios, requiriendo complementarse con otros procedimientos intervencionales (18).
Radiofrecuencia
Una alternativa intervencional a la Neurolisis química es la neuroablación por temperatura. Sin embargo, hay muy pocas publicaciones del uso de radiofrecuencia como alternativa intervencional para el control del dolor pelviano oncológico. Técnicamente es más difícil, ya que requiere que la cánula de radiofrecuencia con su punta activa esté a menos de 5 mm del nervio o ganglio.
Bharti et al (19) reportaron un caso de paciente con cáncer cervicouterino etapa IV con dolor pélvico severo no controlado con opiáceos. Se le realiza radiofrecuencia termal por acceso transdiscal paramediano con aguja recta 150 mm 22 G, cuya punta alcanza borde medial anterior en disco L5S1. Se le realiza lesión termal a 90°C durante 90 segundos, dos veces. La paciente reporta disminución del EVA desde 8/10 a 4/10 con disminución en la ingesta de morfina hasta su fallecimiento.
La calidad de la evidencia de la Neurolisis del plexo hipogástrico superior según las guías de práctica clínica para el manejo intervencional del dolor oncológico publicada por Bhatnagar y Gupta es 2 C+ (20).
Neurólisis del plexo hipogástrico inferior
El plexo hipogástrico inferior se localiza en los tejidos presacros que se encuentran entre las vértebras sacras S2-S4 mediales a los forámenes sacros (21). La indicación de bloqueo del plexo hipogástrico inferior es para control del dolor proveniente de los órganos pélvicos inferiores y los genitales, ya que con frecuencia no es adecuadamente controlado por el bloqueo del plexo hipogástrico superior.
Schultz (22) describió originalmente el abordaje trans-sacral guiado por fluoroscopio, consistente en el abordaje vía transforaminal con aguja curva dirigida desde lateral a medial. La técnica descrita consiste en introducir la aguja a través del foramen sacro posterior, habitualmente S2, y bajo fluoroscopia, guiándolo a través del canal foraminal hasta el foramen sacro anterior, avanzando levemente la aguja hasta la superficie sacra anterior, y confirmando su posición con medio de contraste que debe difundir en el espacio presacro medial (Figura 6).
Bloqueo plexo hipogástrico inferior vía trans-sacral
Figura 6: Bloqueo plexo hipogástrico inferior vía trans-sacral: se observa aguja a través de foramen S2 y el medio de contraste que difunde a nivel presacro.
Sin embargo, no siempre es posible dirigir en la dirección indicada la aguja, y esta técnica tiene el riesgo además de producir neuritis y parestesias de las raíces sacras, dado que se ha demostrado que el líquido inyectado a nivel de foramen S2 difunde hacia las raíces sacras anteriores (23).
Con la finalidad de evitar el daño de las raíces sacras, Choi et al (24) publicaron una técnica de Neurolisis del plexo hipogástrico inferior vía trans-coxígea. Con una aguja curva ingresan desde el borde lateral de la apófisis transversa coxis hacia la línea media sobre la unión sacrocoxígea a un nivel cercano a S2-S3. Aunque promisoria, se necesitan ensayos prospectivos más grandes con evaluación a largo plazo para determinar la seguridad de este abordaje.
Las contraindicaciones generales para los bloqueos neurolíticos simpáticos hipogástricos incluyen la invasión tumoral en el sitio de punción o trayecto, presencia de coagulopatía, infección sistémica o localizada, y obstrucción intestinal. Las complicaciones reportadas son dolor de espalda, hipotensión ortostática, diarrea, punción vascular con hematoma retroperitoneal, lesión de la vejiga o uréteres y daño de raíces o nervios espinales somáticos.
Neurólisis del ganglio impar
El Ganglio Impar o de Walther es una estructura retroperitoneal no pareada, ubicada al final de las cadenas simpáticas lumbosacras bilaterales y suministra fibras nociceptivas y simpáticas al perineo, recto distal, región perianal, uretra distal, vulva/escroto y el tercio distal de la vagina (25, 26, 27).
El ganglio impar está ubicado ligeramente por debajo (hasta 2 cm) de la unión sacrocoxígea (28).
Plancarte describió por primera vez la técnica para la Neurolisis química del ganglio impar guiado por fluoroscopia (29), mediante la introducción de una aguja doblada a través de la membrana anococcígea con un dedo insertado en el recto para guiar la aguja y prevenir la lesión rectal.
Wemm describió una técnica alternativa de Neurolisis del ganglio impar (30) a través del disco sacrocoxígeo.
Este enfoque predomina hoy en día por su fácil técnica, pero puede resultar difícil en pacientes con cambios artríticos en los huesos, fusión de las articulaciones y calcificación de los ligamentos del sacro y el coxis (31). McAllister et al describieron un enfoque paramedial del ganglio.
Las complicaciones asociadas a estas técnicas intervencionales pueden incluir lesión rectal, lesión de los nervios y neuritis (32). Acá también la ablación por radiofrecuencia puede ayudar a reducir las complicaciones asociadas con la Neurolisis química. Sin embargo, como la ubicación exacta del ganglio impar es variable, Reig propuso aumentar la probabilidad de éxito usando dos cánulas en lugar de una, la primera colocada a través del ligamento sacrococcígeo, y la segunda a través de un disco coccígeo.
Otras indicaciones de Neurolisis del ganglio impar incluyen proctitis inducida por radiación (33) coccigodinia, sudoración perianal y dolor tenesmoide (34).
Neurólisis de las raíces sacras bajas
En cánceres pelvianos con infiltración perineal, el control del dolor puede ser incompleto con la simpatectomía realizada a nivel de los plexos hipogástricos y/o ganglio impar. La fenolización intratecal puede considerarse para el dolor perineal somático debido a neoplasias pélvicas (35). Por lo general, se emplea como último recurso para el dolor intratable por cáncer en pacientes terminales con catéter urinario preexistente, ano artificial o incontinencia urinaria y fecal (36). Está contraindicado en pacientes con esperanza de vida ≥6 meses o anomalías de la coagulación.
La técnica consiste en la inyección intratecal lenta de fenol al 10% en glicerina a través de una aguja espinal de 22 g introducida a través del interespacio L5-S1 con el paciente sentado e inclinado hacia atrás en un ángulo de 45° para maximizar el flujo hacia las raíces dorsales o sensoriales (37). La principal complicación fue retención urinaria.
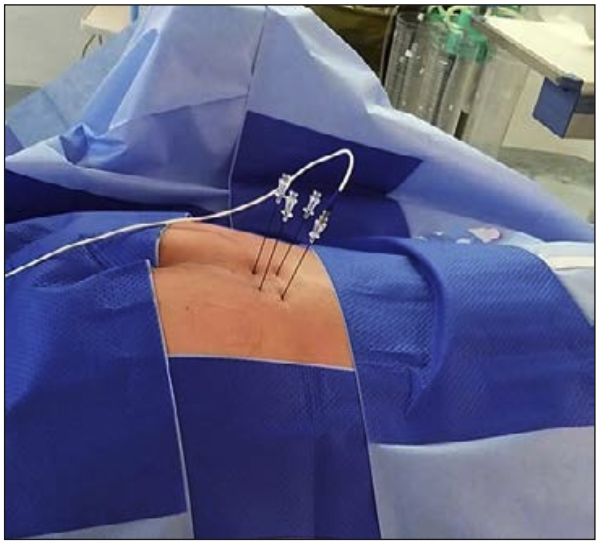
Reyad et al (38) comparó en un estudio la rizotomía química con la rizotomía termal. Cuarenta pacientes portadores de cáncer pélvico y con dolor perineal moderado o severo no controlado con dosis máximas de morfina durante al menos 4 semanas fueron asignados aleatoriamente para recibir rizotomía selectiva mediante ablación térmica por radiofrecuencia (80°C durante 180 segundos) de las raíces sacras S3 unilateral y ablación bilateral de S4 (n = 20), o rizotomía química convencional con fenol hiperbárico al 6% en glicerina (n = 20). Los pacientes fueron evaluados en la intensidad del dolor, el consumo diario de analgésicos, la mejoría funcional, la satisfacción general del paciente, el grado de discapacidad y la aparición de efectos secundarios relacionados con el procedimiento a las 1, 4 y 12 semanas. Los resultados fueron comparables en ambos grupos en cuanto al control del dolor y la mejoría funcional. Sin embargo, la incidencia de complicaciones mayores fue significativamente mayor en el grupo fenol (5 pacientes, 25%), entre ellas 4 pacientes desarrollaron disfunción vesical que requirió instalación de sonda vesical, 2 pacientes tuvieron incontinencia fecal y 1 paciente presentó paresia. En nuestra unidad preferimos la rizotomía termal unilateral en S3 y radiofrecuencia pulsada en la S3 contralateral, más ablación termal bilateral en S4 (Figura 7).
Figura 7: Se observan 4 cánulas de radiofrecuencia en S3 y S4 para realizar rizotomía termal unilateral en S3 y radiofrecuencia pulsada en la S3 contralateral, más rizotomía termal bilateral en S4.
Intervencionismo en metástasis óseas sacroilíacas
Los tumores que invaden el sacro y/o el ilion a menudo representan una enfermedad metastásica incurable, y el tratamiento está dirigido a paliar los síntomas y control del dolor. Sin embargo, el dolor óseo es difícil de tratar y la terapia con opioides sistémicos con frecuencia es insuficiente para controlar el dolor, y su incremento en las dosis está limitado por los efectos adversos. El desarrollo de nuevas técnicas intervencionales permite un mejor control del dolor, pero su efectividad está limitada por la ubicación de las masas tumorales. De acuerdo con Hutson et al [39] he estandarizado los distintos abordajes de las terapias intervencionales según la ubicación de las masas tumorales (Tabla 2).
Tabla 2
Tumor sacro o iliaco que no invade articulación sacroilíaca
Los tumores sacros o iliacos que no comprometen los forámenes sacros ni la articulación sacroilíaca pueden responder favorablemente a infiltraciones de la articulación sacroilíaca con corticoides, la que puede repetirse. Para obtener una mayor duración de la analgesia se ha utilizado Fenol al 6-7% intraarticular (40,41).
Si el tumor compromete la cresta iliaca puede comprimir los nervios cluneales superiores (42), con dolor referido a espalda y glúteo, y la terapia intervencional sugerida es Neurolisis de los nervios cluneales (43).
Tumor sacro o iliaco que invade articulación sacroilíaca
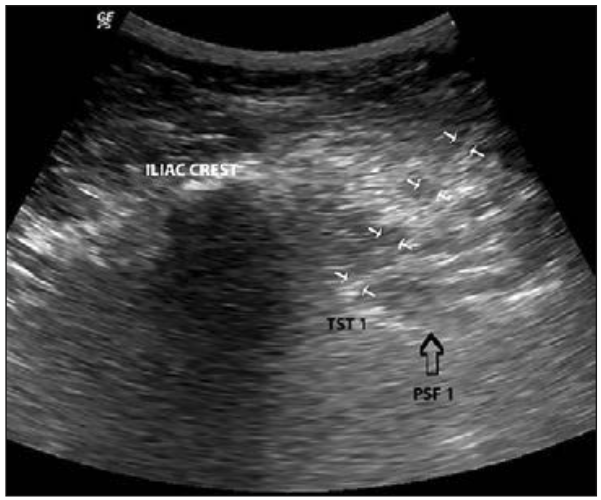
Si el tumor invade la articulación sacroilíaca pero no compromete los forámenes sacros, la técnica intervencional de elección es la ablación de los ramos mediales lumbares L4 y L5 y los ramos laterales sacros S1-S3. El autor prefiere la ablación por radiofrecuencia en vez de la ablación química por el riesgo de difusión foraminal del químico (44). La ablación de los ramos laterales sacros puede ser también por radiofrecuencia refrigerada que amplía el área de lesión y mejora la efectividad (45). La ablación también puede realizarse bajo ecografía (Figura 8) (46,47), que puede ser un recurso útil cuando los pacientes no toleran la posición prona.
Figura 8: Visión ecográfica muestra cánula (flechas blancas) que alcanza apófisis transversa sacra (TST 1) en borde lateral de foramen sacro S1 (PSF 1).
Tumor sacro que invade forámenes sacros
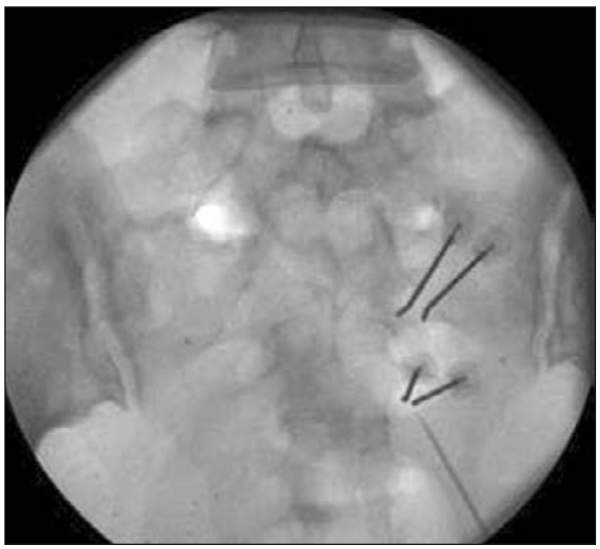
Si la visión fluoroscópica permite identificar los forámenes el autor realiza rizólisis de las raíces sacras por radiofrecuencia y para una mejor cobertura de la lesión se realiza ablación bipolar 80°C durante 90 segundos (Figura 9) (48). Si no es posible visualizar los forámenes se asume una invasión difusa sacroilíaca.
Figura 9: Visión fluoroscópica de cánulas de radiofrecuencia bipolar en S2 y S3.
Tumor con invasión difusa sacroilíaca
Si la invasión tumoral sacroilíaca es difusa, se debe evaluar la analgesia neuroaxial, que puede ser epidural o intratecal, completamente externalizada, mixta o con la implantación de una bomba de infusión intratecal de morfina [49]. En etapa final de vida se utiliza un catéter peridural o intratecal, que puede o no estar tunelizado para la administración de morfina. En caso de una esperanza de vida 1-6 meses el autor recomienda la utilización de un catéter intratecal tunelizado con reservorio subcutáneo conectado a bomba de infusión externalizada (50).
La morfina intratecal es más barata, asociada con una mejor analgesia y calidad de vida, tiene menos efectos adversos, y requiere un sistema de infusión más compacto y portátil que se puede mantener por un período más largo para rellenar en comparación con los sistemas de infusión epidural (51-54). En caso de esperanza de vida > 6 meses se recomienda la implantación de una bomba de infusión intratecal de morfina (55).
En caso de dolor pélvico unilateral o localizado se ha propuesto utilizar un bloqueo continuo del erector de la espina (56).
Intervencionismo en la plexopatía lumbosacra maligna
El plexo lumbosacro está conformado por las ramas anteriores de los nervios espinales lumbares y sacros. La plexopatía lumbosacra maligna es una lesión de los nervios del plexo lumbosacro, causada directamente por el tumor o secundariamente por cirugía o quimioterapia o radioterapia. En el caso de ser secundaria a cirugía, esta complicación es causada por varios factores, incluido el daño quirúrgico directo (disección cercana al músculo psoas), daño isquémico intraoperatorio (retracción y presión prolongadas), hematoma o absceso postoperatorio, o desarrollo de fibrosis o cicatrices en el largo plazo.
En el caso de plexopatía causada por compresión tumoral o difusión perineural, el segmento más comúnmente afectado es el L4-S1 (>50% de los casos), seguido por el segmento L1-L4 (31%) y finalmente la panplexopatía (alrededor del 10%). La plexopatía lumbosacra ocurre dentro de un año del diagnóstico en más de un tercio de los pacientes con tumores primarios, pero en el 15% de los casos la plexopatía estaba presente en el diagnóstico inicial de cáncer (57,58,59).
Lee et al (60) estudiaron a 9 pacientes con plexopatía lumbosacra maligna secundaria a diseminación perineural de tumores pélvicos (próstata, cérvix, recto). En 2 de los casos los pacientes presentaron dolor (inguinal y anal) previamente al diagnóstico del cáncer.
En pacientes terminales y sintomáticos graves, se puede considerar una rizotomía dorsal. Se ha demostrado que la rizotomía causa una reducción significativa en el dolor y el uso de opioides en esta población (61). El bloqueo neurolítico intratecal interrumpe la entrada en la médula espinal de las aferencias nociceptivas provenientes de los tejidos lesionados por el tumor, y las indicaciones para la Neurolisis intratecal incluyen pacientes con esperanza de vida corta (menos de 6 meses) y con dolor severo de cáncer intratable y bien localizado (62,63). Las complicaciones incluyen paresia o parálisis, disfunción de la vejiga y trastornos intestinales (64).
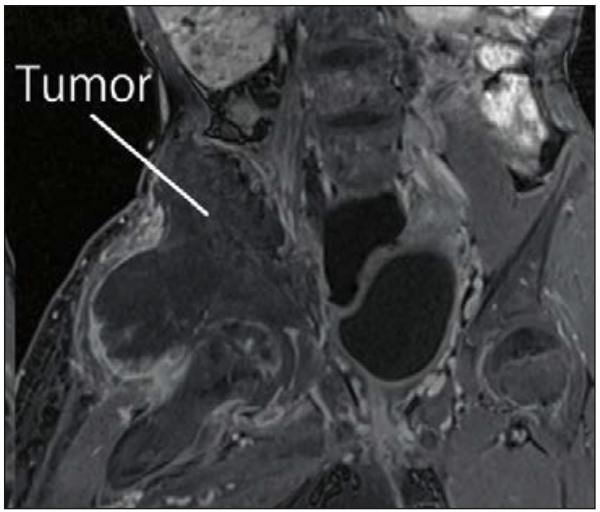
Tashiro et al (65) realizaron rizólisis intratecal con fenol en paciente pediátrica de 10 años con tumor iliaco que comprometía el plexo lumbar (Figura 10). Le inyectaron a nivel L3L4 0,2 ml de Fenol al 10% en glicerol logrando bloqueo de los metámeros T12-L5.
Figura 10: La resonancia magnética muestra que el tumor ilíaco invade el plexo lumbar derecho (65).
Murugesan et al [66] reportaron un caso de un paciente de 34 años con un liposarcoma que comprometía foramen sacro S1, el músculo piriforme y el nervio ciático izquierdo, con dolor neuropático lumbosacro refractario a farmacoterapia. Le realizaron radiofrecuencia pulsada (RFP) de los ganglios de las raíces dorsales entre L3 y S1, a 42°C durante 120 segundos. Con un seguimiento de 11 meses el EVA pre PRF era de 9/10 y post PRF disminuyó a 2/10.
La European Pain Federation Task Force (67) proporciona una recomendación débil para los bloqueos neurolíticos, pero argumenta que pueden ser útiles en pacientes cuidadosamente seleccionados.
Dolor Crónico Pelviano post Quirúrgico
Dado que la sobrevida a largo plazo de los pacientes está mejorando gracias a avances en terapias oncológicas y quirúrgicas, también se ha ido incrementando el número de pacientes que sufren efectos adversos por los tratamientos curativos y/o paliativos contra el cáncer, incluyendo las cirugías, la quimioterapia, y la radioterapia. Estos síndromes de dolor crónico pelviano post quirúrgicos a menudo son difíciles de diagnosticar, especialmente cuando se presentan simultáneamente con los síndromes de dolor inducidos por el cáncer.
Con la finalidad de estandarizar las terapias intervencionales para el control del dolor, he clasificado los distintos síndromes de dolor crónico pelviano post quirúrgicos en 3 grandes grupos (Tabla 3).
Tabla 3
Síndrome del Recto Fantasma
El síndrome del recto fantasma es cuando las personas continúan teniendo sensaciones de un recto intacto que ya no está presente. La fisiopatología exacta no se conoce, pero se sospecha que el nervio pudendo extirpado se regenera y envía mensajes falsos al cerebro. La resección abdominoperineal con colostomía permanente sigue siendo la indicación terapéutica en pacientes con cáncer rectal resistente a quimiorradioterapia. Cherng et al (68) encontraron que el 55% de los pacientes estudiados experimentaron este tipo de dolor del recto fantasma después de una cirugía de resección rectal.
Normalmente, el dolor ocurre dentro de la primera semana después de la amputación, pero este tipo de dolor en el muñón puede ocurrir en el sitio quirúrgico también varios meses o años después de la cirugía. Los síntomas suelen ser leves y se resuelven espontáneamente en el 50% de los casos, pero en algunos pacientes, el dolor del recto puede ser persistente, y en otros pacientes puede manifestarse como dolor lancinante y/o punzante, ardor, pulsación, o sensación de aplastamiento. Es referido más comúnmente al área quirúrgica sacrococcígea y perianal y puede ser exacerbado por los movimientos.
Abdel Ghaffar et al (69) evaluaron el bloqueo combinado de impar ganglionar y pregabalina para el tratamiento del síndrome de dolor del recto fantasma. Un total de 40 pacientes fueron asignados aleatoriamente en dos grupos: grupo A (n = 20) recibió pregabalina 150 mg dos veces al día, y el grupo B (n=20) recibió pregabalina 150 mg dos veces al día y bloqueo del ganglio impar, usando 5 ml de bupivacaína al 5% con 14 mg/2 ml de betametasona (Figura 11). El bloqueo del ganglio impar con pregabalina fue superior en mejorar el dolor y la calidad de vida en los pacientes con síndrome de dolor del recto fantasma comparado con la pregabalina sola.
Figura 11: Se observa medio de contraste con la distribución del fármaco por delante del disco sacrocoxígeo.
Mialgia Tensional del Piso Pélvico
Las cirugías, la radiación y la quimioterapia, son factores de riesgo comprobados para dolor y disfunción del piso pélvico.
La mialgia por tensión del piso pélvico es la principal causa somática de dolor pélvico crónico no oncológico y se relaciona con dispareunia, urgencia/frecuencia urinaria, cistitis intersticial, vulvodinia, proctalgia, coccigodinia y dolor pélvico generalizado. Esta mialgia se caracteriza por un piso muscular pélvico hipertónico con puntos gatillo miofasciales en toda la musculatura. Estos puntos gatillo generalmente refieren el dolor a la parte inferior del abdomen, región suprapúbica, caderas, perineo, cóccix y/o región lumbosacra. Se ha demostrado la efectividad de la infiltración con toxina botulínica en la musculatura de piso pélvico (70). En dolor por cáncer de cabeza y cuello, mama y dolor post radioterapia, la toxina botulínica ha demostrado efectividad (71,72), pero en dolor oncológico pélvico no hay aún recomendaciones con buena evidencia para el uso de toxina botulínica.
Conclusión
El dolor oncológico severo ocurre hasta en el 60% de los pacientes con cáncer pélvico, siendo refractario al tratamiento médico hasta en el 30% de los casos. Las presentaciones pueden incluir un síndrome de dolor visceral pélvico, una plexopatía lumbosacra maligna, dolor por metástasis óseas sacroilíacas y dolor pélvico posquirúrgico crónico. Se han desarrollado terapias intervencionales mínimamente invasivas para tratar el dolor, que en etapas tempranas en pacientes con dolor no controlado mejoran su condición de salud, mejoran su rendimiento para enfrentar la enfermedad y su tratamiento, y evitan o retrasan la escalada de opioides con sus efectos adversos asociados. Se requiere estandarizar las técnicas, mejorar la calidad de los ensayos clínicos y desarrollar guías de práctica clínica en un trabajo conjunto con oncología.
Conflicto de Intereses
Autor(es) no declaran conflicto de interés en el presente trabajo.
Referencias Bibliográficas
- Paraskevas G, Tsitsopoulos P, Papaziogas B, Natsis K, Martoglou S, Stoltidou A, Kitsoulis P. Variability in superior hypogastric plexus morphology and its clinical applications: a cadaveric study. Surg Radiol Anat. 2008;30(6):481-488.
- Kim H, Nam YS, Lee UY, Kim IB, Kim YS. Anatomy of the superior hypogastric plexus and its application in nerve-sparing paraaortic lymphadenectomy. Folia Morphol (Warsz). 2021;80(1):70-75.
- Plancarte R, Amescua C, Patt RB, Aldrete JA: Superior hypogastric plexus block for pelvic cancer pain. Anesthesiology 1990, 73:236-239.
- Plancarte R, de Leon-Casasola OA, El-Helaly M, et al.: Neurolytic superior hypogastric plexus block for chronic pelvic pain associated with cancer. Reg Anesth 1997, 22:562-568.
- Pérez-Moreno DP, Plancarte-Sánchez R, Hernández-Porras C, Guillén-Núñez M. Effectiveness of the superior hypogastric plexus neurolytic block in the management of pelvic abdominal pain in adult patients diagnosed with cancer: A systematic literature review. Revista Chilena de Anestesia 2020;49:(6)813-821
- Waldman SD, Wilson WL, Kreps RD. Superior hypogastric plexus block using a single needle and computed tomography guidance: Description of a modified technique. Reg Anesth 1991;16:286-7.
- Gamal G, Helaly M, Labib YM. Superior hypogastric block: transdiscal versus classic posterior approach in pelvic cancer pain. Clin J Pain. 2006;22(6):544-7. Available DOI:http://www.ncbi.nlm.nih.gov/pubmed/16788341
- Liliang PC, Hung CM, Lu K, & Chen HJ. (2018). Fluoroscopically-guided superior hypogastric plexus neurolysis using a single needle: a modified technique for a posterolateral transdiscal approach. Pain Physician, 21, E341-E345.
- McDonald JS. Management of chronic pelvic pain. Obstet Gynecol Clin North Am 1993;20:817-38.
- Wechsler RJ, Maurer PM, Halpern EJ, Frank ED. Superior hypogastric plexus block for chronic pelvic pain in the presence of endometriosis: CT techniques and results. Radiology 1995;196:103-6.
- Tavakoli F, Yousefshahi F, Dabir A, Majedi H. Superior Hypogastric Plexus Block in the Lateral Position: A Case Report. Anesth Pain Med. 2019 Oct 21;9(5):e94706. doi: 10.5812/aapm.94706.
- Kanazi GE, Perkins FM, Thakur R, & Dotson E. New technique for superior hypogastric plexus block. Regional Anesthesia and Pain Medicine, 1999;24(5):473-476.
- Nabil D, and Eissa AA. Evaluation of posteromedial transdiscal superior hypogastric block after failure of the classic approach, Clinical Journal of Pain, vol. 2010;26(8):694- 697.
- Mishra S, Bhatnagar S, Gupta D, Thulkar S. Anterior ultrasound-guided superior hypogastric plexus neurolysis in pelvic cancer pain. Anaesth Intensive Care 2008;36(5):732-5.
- Mishra S, Bhatnagar S, Rana SPS, Khurana D, Thulkar S. Efficacy of the Anterior Ultrasound-Guided Superior Hypogastric Plexus Neurolysis in Pelvic Cancer Pain in Advanced Gynecological Cancer Patients, Pain Medicine, June 2013;14(6):837-842, https://doi.org/10.1111/pme.12106
- Abdelghaffar NA, Farahat TE. Fluoroscopic anterior approach versus ultrasound guided superior hypogastric plexus neurolysis in cancer pelvic pain: a randomized controlled study. BMC Anesthesiol. 2022 Dec 27;22(1):403. doi: 10.1186/s12871-022-01948-3.
- Amr YM, Makharita MY. Neurolytic sympathectomy in the management of cancer pain-time effect: a prospective, randomized multicenter study. J Pain Symptom Manage. 2014 Nov;48(5):944-56.
- Mercadante S. Sympathetic blocks and disease progression modifying pain mechanisms. Reg. Anesth. Pain Med. 2003;28:586–587. doi: 10.1097/00115550- 200311000-00024.
- Bharti N, Singla N, Batra Y. Radiofrequency ablation of superior hypogastric plexus for the management of pelvic cancer pain. Indian Journal of Pain 2016;30(1):58. DOI: 10.4103/0970-5333.173481
- Bhatnagar S, Gupta M. Evidence-based Clinical Practice Guidelines for Interventional Pain Management in Cancer Pain. Indian J Palliat Care. 2015 May-Aug;21(2):137-47. doi: 10.4103/0973-1075.156466.
- Mohamed SA, Ahmed DG, Mohamad MF. Chemical neurolysis of the inferior hypogastric plexus for the treatment of cancer-related pelvic and perineal pain. Pain Res Manag. 2013;18:249-52.
- Schultz DM. Inferior hypogastric plexus blockade: A transsacral approach. Pain Physician, 2007;10:757-63.
- Stogicza A, Trescot AM, Racz E, Magyar L, Keller E. Inferior Hypogastric Plexus Block Affects Sacral Nerves and the Superior Hypogastric Plexus. International Scholarly Research Network ISRN Anesthesiology Volume 2012, Article ID 686082, 5 pages. doi:10.5402/2012/686082
- Choi HS, Kim YH, Han JW, Moon DE. A new technique for inferior hypogastric plexus block: a coccygeal transverse approach -a case report-. Korean J Pain. 2012 Jan;25(1):38- 42. doi: 10.3344/kjp.2012.25.1.38.
- Johnston PJ, Michalek P, . Blockade of the ganglion impar (Walther), using ultrasound and a loss of resistance technique. Prague Med Rep. 2012;113:53-7.
- Reig E, Abejón D, del Pozo C, Insausti J, Contreras R, . Thermocoagulation of the ganglion impar or Ganglion of Walther: Description of a modified approach. Preliminary results in chronic, nononcological pain. Pain Pract. 2005;5:103-10.
- Green IC, Cohen SL, Finkenzeller D, Christo PJ, . Interventional therapies for controlling pelvic pain: What is the evidence? Curr Pain Headache Rep. 2010;14:22-32. 28. Oh CS, Chung IH, Ji HJ, Yoon DM. Clinical implications of topographic anatomy on the ganglion impar. Anesthesiology. 2004;101:249-50.
- Plancarte R, Amescua C, Patt RB, Allende S. Presacral blockade of the ganglion of Walther (ganglion impar) Anesthesiology. 1990;73:A751
- Wemm K, Saberski L. Modified approach to block the ganglion impar (ganglion of Walther) Reg Anesth. 1995;20:544-5.
- McAllister, R. K., Carpentier, B. W., & Malkuch, G. Sacral postherpetic neuralgia and successful treatment using a paramedial approach to the ganglion impar. The Journal of the American Society of Anesthesiologists, 2004;101(6):1472-1474.
- Reig E, Abejón D, Del Pozo C, Insausti J, & Contreras R. Thermocoagulation of the ganglion impar or ganglion of Walther: description of a modified approach. Preliminary results in chronic, nononcological pain. Pain Practice, 2005;5(2):103-110.
- Khosla A, Adeyefa O, Nasir S, . Successful treatment of radiation-induced proctitis pain by blockade of the ganglion impar in an elderly patient with prostate cancer: A case report. Pain Med. 2013;14:662-6.
- Lim SJ, Park HJ, Lee SH, Moon DE, . Ganglion impar block with botulinum toxin type A for chronic perinealpain-a case report. Korean J Pain. 2010;23:65-9.
- Vissers KC, Besse K, Wagemans M, Zuurmond W, Giezeman MJ, Lataster A, et al. Pain in patients with cancer. Pain Pract. 2011;11:453-75.
- Christo PJ, Mazloomdoost D. Interventional pain treatments for cancer pain. Ann N Y Acad Sci. 2008;1138:299-328.
- Ischia S, Luzzani A, Ischia A, Magon F, Toscano D. Subarachnoid neurolytic block (L5-S1) and unilateral percutaneous cervical cordotomy in the treatment of pain secondary to pelvic malignant disease. Pain 1984;20:139-49.
- Reyad RM, Hakim SM, Abbas DN, Ghobrial HZ, Mansour E. A Novel Technique of Saddle Rhizotomy Using Thermal Radiofrequency for Intractable Perineal Pain in Pelvic Malignancy: A Pilot Study. Pain Physician. 2018 Nov;21(6):E651-E660.
- Nathan Hutson, MD, Joseph C Hung, MD, Vinay Puttanniah, MD, Eric Lis, MD, Ilya Laufer, MD, Amitabh Gulati, MD, Interventional Pain Management for Sacroiliac Tumors in the Oncologic Population: A Case Series and Paradigm Approach, Pain Medicine, Volume 18, Issue 5, May 2017, Pages 959–968, https://doi.org/10.1093/pm/pnw211
- Ward S, Jenson M, Royal MA, Movva V, Bhakta B, Gunyea I. Fluoroscopy-guided sacroiliac joint injections with phenol ablation for persistent sacroiliitis: a case series. Pain Pract. 2002 Dec;2(4):332-5.
- Khaleel KA & Al-Attar Z. Phenol Injection versus Depomedrol Injection in Sacroiliac Joint Pain. Sch Acad J Pharm, March, 2020;9(3):120-123.
- Tubbs RS1, Levin MR, Loukas M, Potts EA, Cohen-Gadol AA. Anatomy and landmarks for the superior and middle cluneal nerves: Application to posterior iliac crest harvest and entrapment syndromes. J Neurosurg Spine 2010;13(3):356-9.
- Visnjevac O, Pastrak M, Ma F, Visnjevac T, Abd-Elsayed A. Radiofrequency Ablation of the Superior Cluneal Nerve: A Novel Minimally Invasive Approach Adopting Recent Anatomic and Neurosurgical Data. Pain Ther. 2022 Jun;11(2):655-665.
- Patel N, Gross A, Brown L, Gekht G. A randomized, placebo-controlled study to assess the efficacy of lateral branch neurotomy for chronic sacroiliac joint pain. Pain Med 2012;13(3):383-98.
- Maalouly J, Rao PJ. Cooled radiofrequency ablation of the sacroiliac joint a retrospective case series. BMC Musculoskelet Disord 24,261(2023).
- Le VT, Nguyen AM & Do PT. Ultrasound-guided lateral branch radiofrequency neurotomy for sacroiliac joint pain after lumbosacral spinal fusion surgery. Sci Rep 2023;13:6670 (2023).
- Kokar S, Mercan Ö, Akgün K. Ultrasound-guided lateral branch radiofrequency ablation for sacroiliac joint pain. Turk J Phys Med Rehabil. 2022 Aug 25;68(3):430-434.
- Kim JH, Ahn SH, Cho YW, Kwak SG & Kim HS. Short-Term Effect of Percutaneous Bipolar Continuous Radiofrequencyon Sacral Nerves in Patients Treated for Neurogenic Detrusor Overactivity After Spinal Cord Injury: A Randomized Controlled Feasibility Study. Annals of Rehabilitation Medicine, 2015;39(5):718-725.
- Lynch L. Intrathecal drug delivery systems. Contin Educ Anaesth Crit Care Pain 2014;14:27-31.
- Penn RD, Paice JA, Gottschalk W, Ivankovich AD. Cancer pain relief using chronic morphine infusion. Early experience with a programmable implanted drug pump. J Neurosurg. 1984;61:302-6.
- Nitescu P, Appelgren L, Hultman E, Linder LE, Sjöberg M, Curelaru I. Long-term, open catheterization of the spinal subarachnoid space for continuous infusion of narcotic and bupivacaine in patients with “refractory” cancer pain. A technique of catheterization and its problems and complications. Clin J Pain. 1991;7:143-61.
- Nitescu P, Appelgren L, Linder LE, Sjöberg M, Hultman E, Curelaru I. Epidural versus Intrathecal morphine-bupivacaine: Assessment of consecutive treatments in advanced cancer pain. J Pain Symptom Manage. 1990;5:18-26.
- Dahm P, Nitescu P, Appelgren L, Curelaru I. Efficacy and technical complications of long-term continuous intraspinal infusions of opioid and/or bupivacaine in refractory nonmalignant pain: A comparison between the epidural and the intrathecal approach with externalized or implanted catheters and infusion pumps. Clin J Pain. 1998;14:4-16.
- Gestin Y, Vainio A, Pégurier AM. Long-term intrathecal infusion of morphine in the homecare of patients with advanced cancer. Acta Anaesthesiol. Scand. 1997;41:12-7.
- Ballantyne JC, Carwood CM. Comparative efficacy of epidural, subarachnoid, and intracerebroventricular opioids in patients with pain due to cancer. Cochrane Database Syst Rev. 2005;1:CD005178.
- Aguilar R, Carvajal G, Rocha A, Douglas L, Ubertini A. Bloqueo continuo del erector de la espina para dolor pélvico oncológico. Rev Chil Anest 2020;49:165-169.
- Jaeckle KA, Young DF, Foley KM. The natural history of lumbosacral plexopathy in cancer. Neurology. 1985 Jan;35(1):8-15.
- Ladha SS, Spinner RJ, Suarez GA, Amrami KK, Dyck PJ. Neoplastic lumbosacral radiculoplexopathy in prostate cancer by direct perineural spread: an unusual entity. Muscle Nerve. 2006 Nov;34(5):659-65.
- Song EJ, Park JS, Ryu KN, Park SY, Jin W. Perineural Spread Along Spinal and Obturator Nerves in Primary Vaginal Carcinoma: A Case Report. World Neurosurg. 2018 Jul;115:85-88.
- Lee BC, Kim SW, Kim DH. et al. Lumbosacral plexopathy caused by the perineural spread of pelvic malignancies: clinical aspects and imaging patterns. Acta Neurochir 2022;164:1509-1519.
- Son BC, Yoon JH, Kim DR, Lee SW. Dorsal rhizotomy for pain from neoplastic lumbosacral plexopathy in advanced pelvic cancer. Stereotact Funct Neurosurg. 2014;92(2):109-16.
- Candido K, Stevens RA. Intrathecal neurolytic blocks for the relief of cancer pain. Best Pract Res Clin Anaesthesiol. 2003;17(3):407-28.
- Gerbershagen HU. Neurolysis. Subarachnoid neurolytic blockade. Acta Anaesthesiol Belg. 1981;32:45-57.
- McGarvey ML, Ferrante FM, Patel RS, Maljian JA, Stecker M. Irreversible spinal cord injury as a complication of subarachnoid ethanol neurolysis. Neurology. 2000 Apr 11;54(7):1522-4.
- Tashiro S, Godai K, Daitoku Y, Sato T, Enohata K, Kiyonaga N, Maekawa K, Kanmura Y. Successful intrathecal neurolytic block for the management of cancer pain in a 10-year- old child: a case report. JA Clin Rep. 2021 Apr 12;7(1):33.
- Murugesan A, Daivam I, Nangia S, Burela N, Panda P, and Raghuraman M. Pulsed radiofrequency lesioning of the lumbosacral dorsal root ganglion in a patient with lumbosacral plexopathy due to locally advanced pelvic liposarcoma. Indian Journal of Pain 2021;358(1):75-8.
- Bennett MI, Eisenberg E, Ahmedzai SH, Bhaskar A, O'Brien T, Mercadante S, Krcevski Skvarc N, et al. Standards for the management of cancer-related pain across Europe - A position paper from the EFIC task force on cancer pain. Eur J Pain. 2019;23(4):660-668.
- Cherng CH, Wong CS, Ho ST, Chang CJ. Prevalence and clinical characteristics of phantom rectum syndrome after rectum resection in Chinese patients. Pain Clin 2001;13:113-117.
- Abdel Ghaffar NA, Abdel Ghaffar MA, El-Badrawy A. Computed tomography-guided ganglion impar block for management of phantom rectum pain: a randomized controlled trial. Research and Opinion in Anesthesia & Intensive Care 2019;6:433-438.
- Meister MR, Brubaker A, Sutcliffe S, Lowder JL. Effectiveness of Botulinum Toxin for Treatment of Symptomatic Pelvic Floor Myofascial Pain in Women: A Systematic Review and Meta-analysis. Female Pelvic Med Reconstr Surg. 2021 Jan 1;27(1):e152-e160.
- Mittal SO, Jabbari B. Botulinum Neurotoxins and Cancer-A Review of the Literature. Toxins (Basel). 2020 Jan 5;12(1):32.
- Grenda T, Grenda A, Krawczyk P, Kwiatek K. Botulinum toxin in cancer therapy- current perspectives and limitations. Appl Microbiol Biotechnol. 2022 Jan;106(2):485-495.