Etiquetas
#pandemia #COVID-19 #triaje #toma de decisiones #comorbilidades #cuidados paliativos #Dolor crónico #Neurocirugía #Síndrome de Fracaso de Cirugía Espinal Lumbar #anestesia espinal unilateral #dosis mínima #lateralización #cirugía traumatológica ambulatoria #nervio pudendo #neuralgia #radiofrecuencia pulsada; ultrasonido. #dolor #dolor neuropatico #topiramato #dolor agudo postquirúrgico #dolor incisiona #anestesia #niños #dolor agudo #dolor quirurgico #modelos y teorias #enfermeria #noticias #Investigación en Servicios de Salud #Rehabilitación #ansiedad #emociones #miedo #tristeza #Parche #Buprenorfina #Fentanilo #problemas sociales #síndrome pediátrico inflamatorio multisistémico #fibromialgia #narrativas #experiencia #Afrontamiento #estados emocionales #dolor de espalda #Cuidado paliativo #opioidesRevista El Dolor 77 | Noviembre 2024 - Año 34 | Originales
Manejo Intervencional del dolor torácico de origen oncológico. Propuesta
Aceptado: 04-05-2024
Páginas 16-22
Cárcamo, César(1)
(1) Unidad de Cuidados Paliativos y Dolor Hospital del Salvador, Clínica Santa María y Clínica Dávila.
Resumen
El dolor es un síntoma frecuente de presentación en los casos de cáncer pulmonar y es un dolor refractario debido a la multiplicidad de generadores de dolor. Las presentaciones pueden ser una invasión pleural, metástasis costales, invasión mixta o síndrome costo-pleural, tumor de Pancoast, y metástasis vertebral con o sin invasión paravertebral. Se han desarrollado terapias intervencionales mínimamente invasivas para tratar el dolor, que en etapas tempranas en pacientes con dolor no controlado mejoran su condición de salud, mejoran su rendimiento para enfrentar la enfermedad y su tratamiento, y evitan o retrasan la escalada de opioides con sus efectos adversos asociados. Se requiere estandarizar las técnicas, mejorar la calidad de los ensayos clínicos y desarrollar guías de práctica clínica en un trabajo conjunto con oncología.
Palabras clave: cáncer pulmonar; dolor por cáncer; técnicas ablativas; bloqueo neurolítico; neurectomía; denervación.
Abstract
Pain is a frequent presenting symptom in cases of lung cancer and it is a refractory pain due to the multiplicity of pain generators. Clinical presentations may be pleural invasion, rib metastasis, mixed invasion or costo-pleural syndrome, Pancoast tumor, and vertebral metastasis with or without paravertebral invasion. Minimally invasive interventional therapies have been developed to treat pain, which in early stages in patients with uncontrolled pain improve their health condition, improve their performance in coping with the disease and its treatment, and prevent or delay the escalation of opioids with their associated side effects. It is necessary to standardize the techniques, improve the quality of clinical trials and develop clinical practice guidelines in a joint effort with oncology.
Key words: lung neoplasms; cancer pain; ablation techniques; neurolytic block; neurectomy; denervation.
Introducción
El dolor es un síntoma frecuente de presentación en los casos de cáncer pulmonar y es un dolor refractario debido a la multiplicidad de generadores de dolor (visceral-somático-neuropático).
La invasión tumoral del pulmón y la pared torácica y la pleura generan una serie de síndromes (Tabla 1) que se presentan con cuadros clínicos distintos y las estrategias intervencionales propuestas son distintas también. Las presentaciones pueden ser una invasión pleural, metástasis costales, invasión mixta o síndrome costo-pleural, tumor de Pancoast, metástasis vertebral con o sin invasión paravertebral, y dolor relacionado con procedimientos terapéuticos, tales como síndrome de dolor post toracotomía, post mastectomía y dolor inducido por quimioterapia o radioterapia.
Tabla 1
Síndrome de dolor de la pared torácica
El dolor en la pared torácica es un síntoma grave e incapacitante que presentan la mitad de los pacientes con cáncer pulmonar. Es ipsilateral al tumor y puede involucrar desde solo una metástasis costal o un compromiso de la pleura hasta llegar a un síndrome costopleural o compromiso de toda la pared que se observa frecuentemente en los Mesoteliomas.
Normalmente el dolor es severo y de carácter mixto, neuropático y nociceptivo. El dolor nociceptivo asociado a las metástasis costales se explica por la lisis tisular, el estiramiento del periostio y la fractura patológica. Habitualmente se compromete el nervio intercostal por tanto se agrega el componente neuropático del dolor (Figura 1). En estos síndromes normalmente el dolor es unilateral de carácter mixto, neuropático y nociceptivo, y muy difícil de tratar. El movimiento del tronco agrega además un dolor irruptivo de difícil control (1).
Figura 1. Se observa metástasis costal con lisis tisular, estiramiento del periostio y fractura patológica.
Plexopatía Braquial Maligna
Consiste en el conjunto de signos y síntomas producidos por compromiso del plexo braquial y las dos primeras raíces torácicas y/o sistema simpático cervical por la presencia de un tumor pulmonar en el hueco supraclavicular o de mama a nivel axilar, o plexopatía secundaria a fibrosis post radioterapia. Aunque se produce invasión maligna del plexo braquial en solo el 3% de los cánceres de pulmón y menos del 0,5% de los de cánceres de mama, representa un dolor intratable en el 31% de los pacientes con cáncer de pulmón y 37% de los pacientes con cáncer de mama (2, 3).
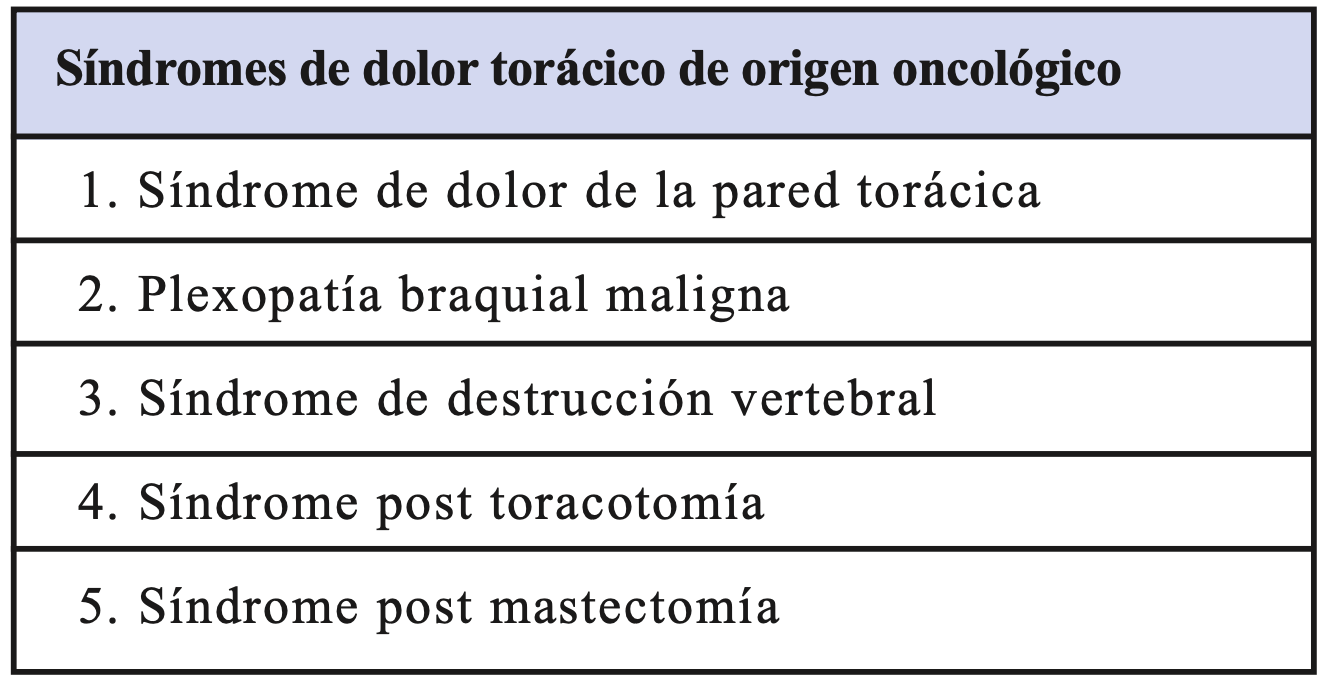
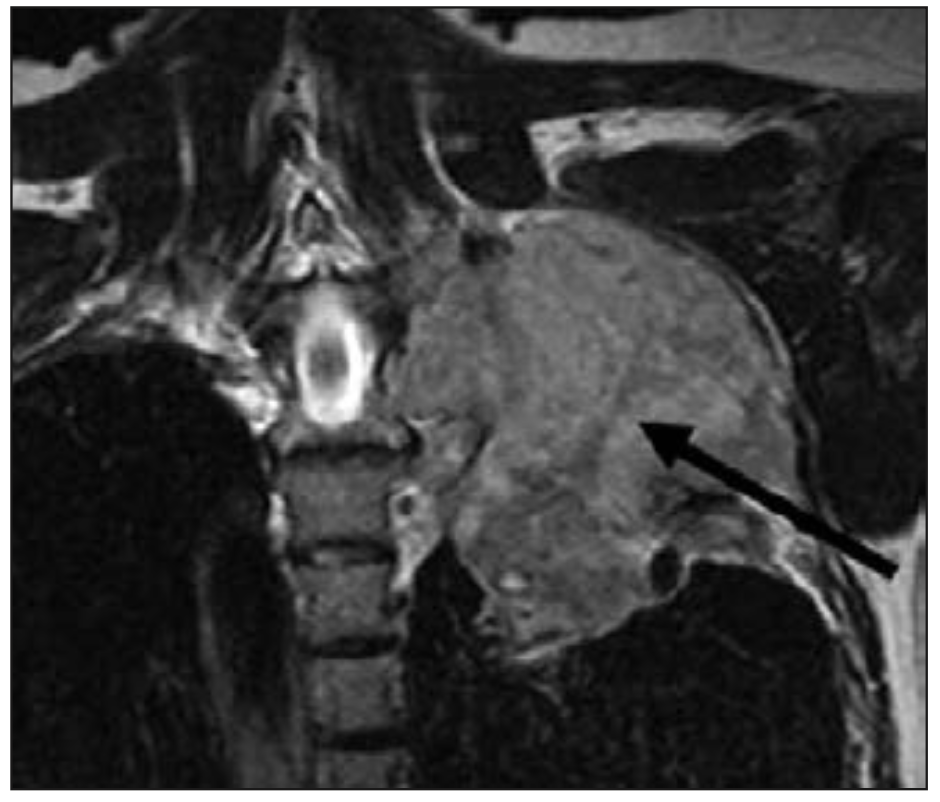
Cuando es una extensión local de una lesión tumoral en el sulcus pulmonar superior, se denomina síndrome de Pancoast (4). En el Pancoast el síntoma más frecuente de presentación es el dolor de hombro y/o del brazo ipsilateral al tumor, como consecuencia de la extensión local del tumor a la pleura parietal, plexo braquial inferior, cuerpos vertebrales y las tres primeras costillas. El dolor de hombro se puede irradiar hacia la axila y el borde cubital del brazo. Además del dolor de hombro o brazo puede aparecer un síndrome de Horner asociado, por compromiso del sistema simpático cervical. El síndrome de Horner incluye ptosis palpebral, miosis, enoftalmos y en ocasiones anhidrosis facial, todos ellos ipsilaterales al tumor.
Figura 2. Imagen coronal de RNM T2W muestra tumor en ápex pulmonar izquierdo (Tumor de Pancoast) que invade fosa supraclavicular comprimiendo plexo braquial izquierdo (flecha) (5).
Síndrome de destrucción vertebral
Se describen cinco causas de destrucción vertebral: infecciones bacterianas o por hongos, infección tuberculosa, tumores primarios (malignos y benignos), metástasis y enfermedades metabólicas (osteoporosis, enfermedad de Paget) (6).
Los tumores de las vértebras pueden ser de lesiones locales o adyacentes a la columna o a distancia, diseminados por vía hematógena o linfática. Los tumores primarios que con mayor frecuencia metastizan a columna vertebral son pulmonar, de próstata, mama y riñón. Las metástasis vertebrales se encuentran predominantemente en las vértebras torácicas (70%), seguido de las vértebras lumbosacras (22%), y vértebras cervicales (8%).
El dolor de la metástasis ósea vertebral está presente en alrededor de 85% de los pacientes y suele ser progresivo, lento y duele por las noches.
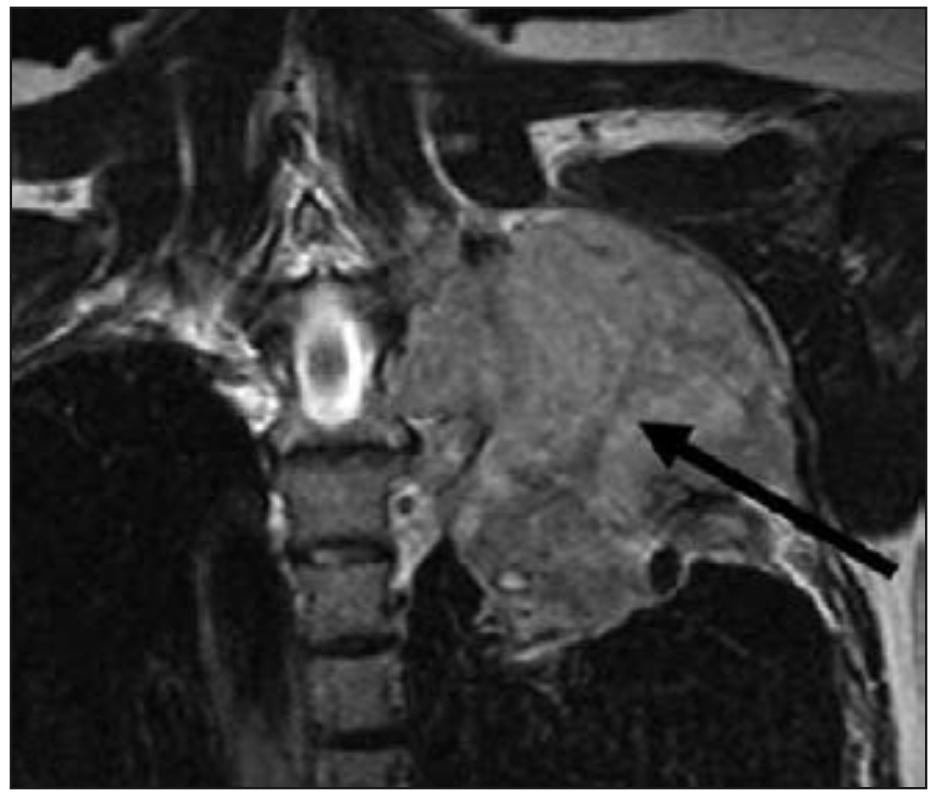
Figura 3. Metástasis ósea a nivel de T7 con compresión medular.
El dolor por metástasis ósea vertebral se clasifica en dolor local, mecánico y radicular. El dolor local se origina en la región o segmento de la columna vertebral afectada por el tumor metastásico y puede reproducirse por presión o percusión en el segmento afectado. El dolor mecánico aumenta con el movimiento del segmento espinal afectado. El dolor radicular puede ocurrir debido a irritación, compresión o invasión de la raíz nerviosa por extensión epidural del tumor metastásico. La compresión de la médula espinal puede también causan dolor (Figura 3). Entre los pacientes que muestran compresión de la médula espinal, 90% presentan dolor, el 47% presenta síntomas neurológicos, y aproximadamente el 60-85% de estos pacientes pueden presentar debilidad motora en el momento de su diagnóstico.
Síndrome post Toracotomía
La definición de la Asociación Internacional para el Estudio del Dolor (IASP) del síndrome de dolor posterior a la toracotomía es la siguiente: Dolor que recurre o persiste a lo largo de una cicatriz de toracotomía al menos 2 meses después del procedimiento quirúrgico (7).
Las vías del dolor en la toracotomía son complejas. El dolor de la piel, los músculos, las costillas y la pleura parietal se transmite a través de los nervios intercostales hasta la asta dorsal de la médula. Además, el nervio vago y el sistema autónomo conducen estímulos nocivos desde la pleura visceral y el parénquima pulmonar. Finalmente, el nervio frénico está relacionado con estímulos nociceptivos del mediastino, diafragma y pleura pericárdica (8).
Síndrome post Mastectomía
La IASP define al Síndrome post Mastectomía como dolor crónico en la cara anterior del tórax, la axila y/o la mitad superior del brazo que comienza después de la mastectomía o cuadrantectomía y persiste durante > 3 meses después de la cirugía.
Se describen cuatro subtipos de dolor neuropático post mastectomía: (1) neuralgia intercostobraquial; (2) dolor secundario a un neuroma que se presenta en la cicatriz quirúrgica y se desencadena por percusión (signo de Tinel); (3) dolor debido al daño a otros nervios, que puede resultar del daño o incluso la tracción de los nervios pectoral, toracodorsal y torácico largo; y (4) dolor fantasma en los senos.
La causa más frecuente (30-50%) del síndrome post mastectomía es la neuralgia intercostobraquial. El nervio intercostobraquial es la rama cutánea lateral del segundo nervio intercostal que surge de T2, y proporciona sensación en la parte medial del brazo, la axila y la pared torácica lateral. El nervio intercostobraquial con frecuencia se sacrifica durante las disecciones de los ganglios linfáticos axilares y casi siempre produce entumecimiento. Sin embargo, en algunos pacientes puede resultar en parestesias dolorosas y dolor neuropático crónico (9, 10).
Manejo Intervencional del dolor de la pared torácica
La invasión del tumor de la pared torácica a menudo es incurable, y el enfoque del tratamiento es la atención paliativa y el control del dolor mediante bloqueo o neurolisis intercostal o paravertebral, o radiofrecuencia del nervio intercostal o del ganglio dorsal, alcohol intraraquídeo, y cordotomía. Estas técnicas intervencionales pueden optimizar el manejo del dolor cuando los opiáceos y fármacos analgésicos no logran un control adecuado del mismo (11).
Neurólisis química
De los 20 pacientes que tuvieron un control óptimo del dolor local, 12 (60%) desarrollaron recurrencia posterior del dolor en el mismo sitio. La mediana de duración del control del dolor fue de 25 días (rango, 5-158 días). Ocho (32%) pacientes no experimentaron dolor hasta el final de sus vidas, su tiempo medio de supervivencia fue relativamente corto (40 días; rango, 5-158 días).
De las complicaciones del procedimiento están el neumotórax, la neuritis, siendo la más temida la paraplejia (13-16).
Recientemente se han publicado reportes de casos de bloqueos neurolíticos en el plano del músculo erector espinal en pacientes con dolor oncológico de la pared torácica. El bloqueo del plano del músculo erector de la columna (ESP) es una técnica descrita por Forero et al, y consiste en inyectar el fármaco en un plano profundo al músculo erector de la columna y superficial al extremo lateral de la apófisis transversa (17).
Choi et al (18) compararon la difusión hacia el espacio paravertebral de 10 ml y 30 ml en cadáveres. Con 10 ml se teñía el ligamento costotransverso superior y con 30 ml se teñía el ligamento costotransverso superior y la tinción avanzaba hacia el espacio paravertebral logrando teñir el nervio espinal.
El efecto clínico de la ESP y los bloqueos retrolaminares se explican por la diseminación paravertebral, foraminal y epidural del anestésico local.
Julio Ramos et al (19) realizaron un ESP con instalación de catéter a nivel T3 en un paciente con mesotelioma. Lograron buen control del dolor con bolos cada 8 h con 10 ml de bupivacaina 0,25% hasta su fallecimiento 66 días más tarde.
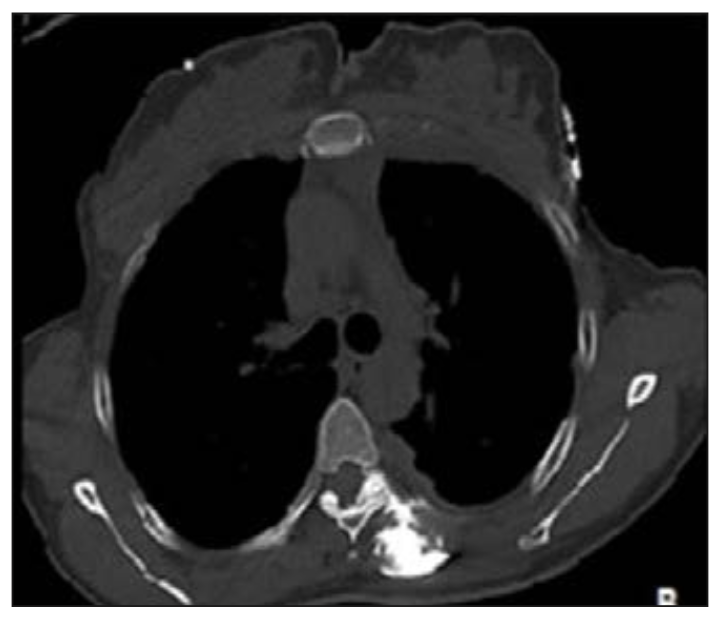
Carolina Hernández et al (20) realizaron un ESP con fenol al 6% diluido con medio de contraste en un paciente con cáncer pulmonar logrando una disminución del dolor torácico desde un EVA 8 a EVA 2. El volumen total fue de 12 ml inyectado en bolos pequeños, y al TAC se observa difusión paravertebral, foraminal y peridural (Figura 4). La paciente presentó dolor tipo quemadura en sitio de inyección que fue controlado con analgésicos no esteroidales.
Figura 4. Se observa difusión del medio de contraste hacia el espacio paravertebral, foraminal y epidural (20).
Dada la corta duración de la neurolisis y los riesgos asociados, algunos autores sugieren realizar primeramente bloqueos con anestésicos locales más corticoides. Además, los bloqueos diagnósticos pueden ayudar a determinar si el dolor torácico es de naturaleza somática (inervado por las raíces nerviosas torácicas) o de naturaleza visceral (la pleura está inervada principalmente por el nervio vago) y así decidir qué niveles torácicos deben ser el objetivo de la neurolisis. Otros autores sugieren realizar primeramente procedimientos ablativos, argumentando la corta esperanza de vida de los pacientes y la dificultad para lograr la posición en decúbito prono para realizar el procedimiento en la medida que el cáncer avanza.
Radiofrecuencia
La radiofrecuencia se ha propuesto como alternativa a la neurolisis química dada su ventaja de producir una lesión localizada, evitando el riesgo de la difusión intratecal del alcohol o fenol y su riesgo de paraplejia. Sin embargo, técnicamente es más difícil ya que requiere que la cánula con su punta activa esté a menos de 5 mm del nervio y a veces el nervio intercostal es difícil de visualizar por ecografía.
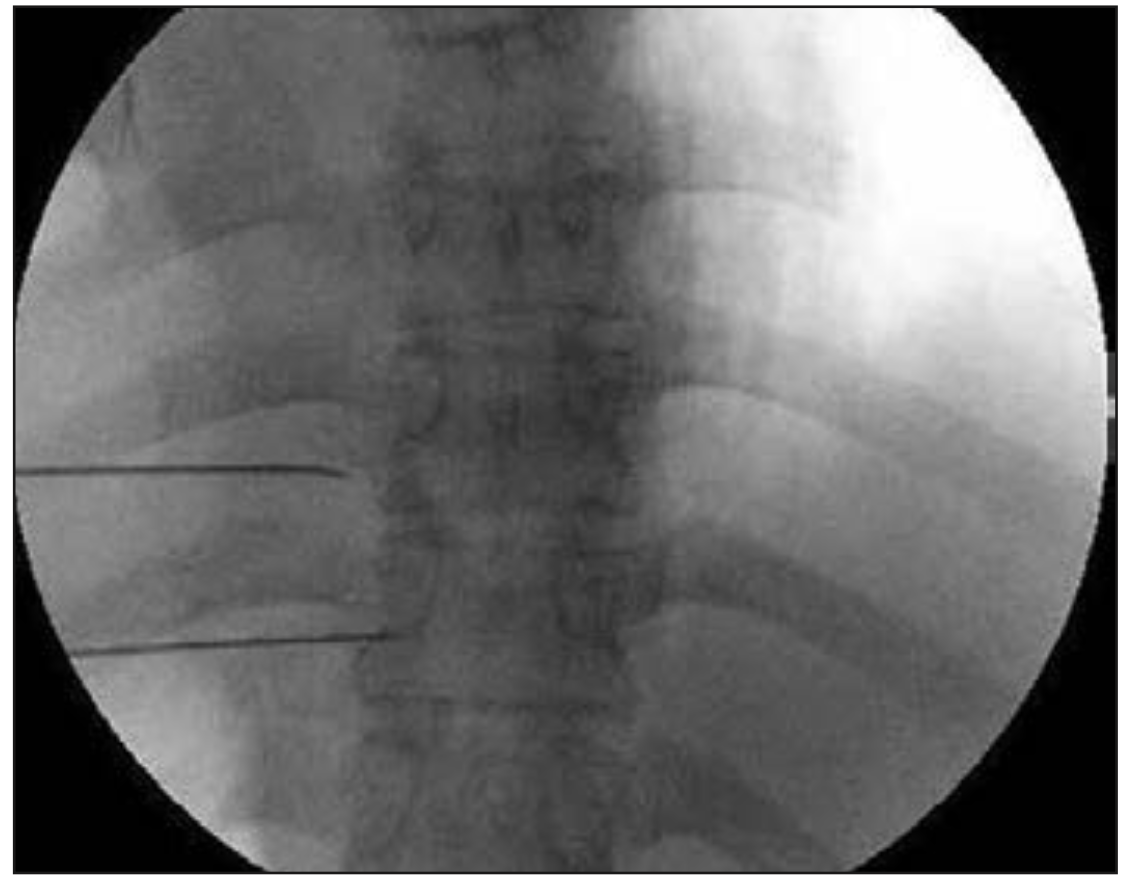
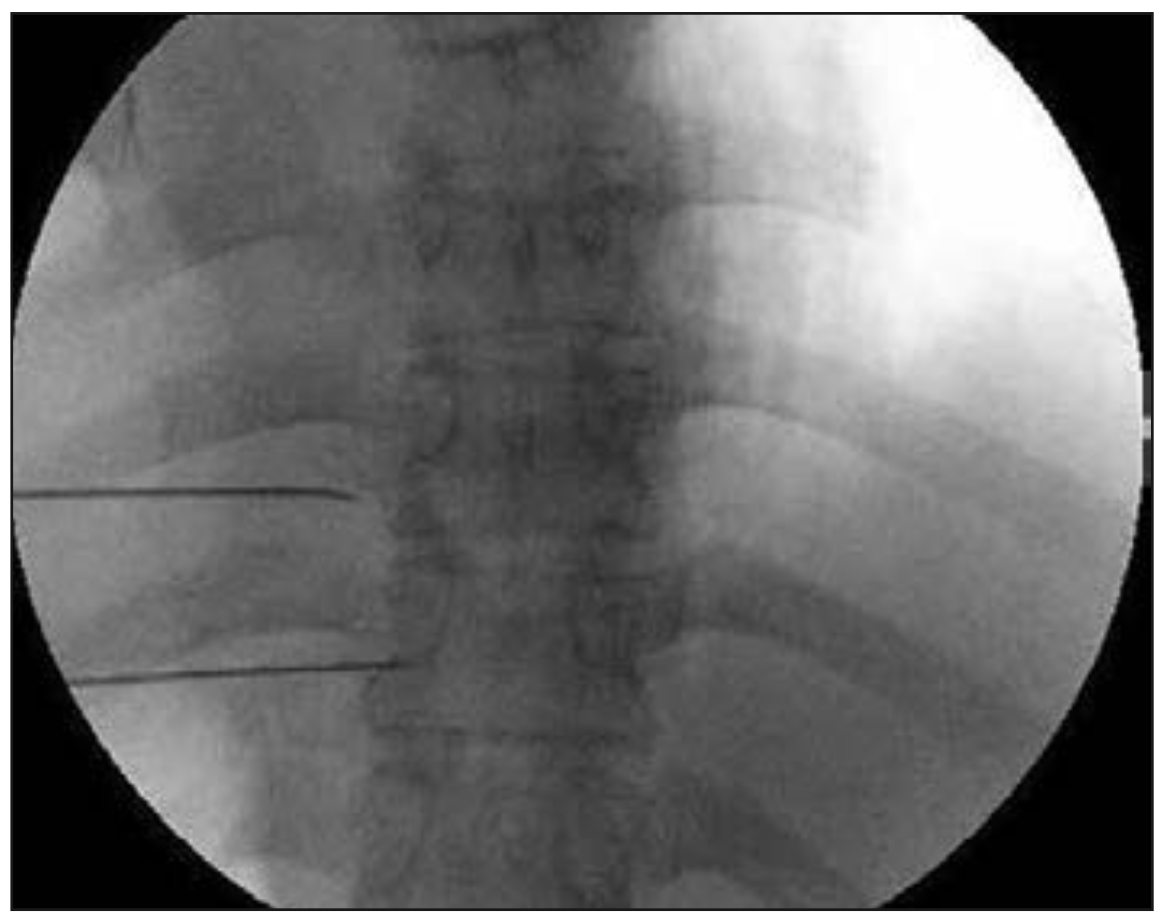
Oh et al (21) publicaron una serie de 100 pacientes con dolor de pared torácica secundario a cáncer, donde realizaron radiofrecuencia termal (80-90°C) a los nervios espinales torácicos, usando cánulas de radiofrecuencia no traumáticas para obtener parestesias a estimulación sensitiva (50 Hz, 0,5 V) bajo fluoroscopia.
Figura 5. Visión fluoroscópica anteroposterior donde se observan cánulas de radiofrecuencia en espacio paravertebral (21).
Previo al procedimiento, el dolor evaluado vía Escala Visual Análoga (EVA) era de 7 (rango 3–10), disminuyendo posteriormente al procedimiento a EVA 4 (0–9) a la semana y al mes después (ambos P <0,001), y manteniéndose en EVA 4 (1-8) a los 6 meses después del procedimiento (P <0.001).
Si el tumor comprime el nervio espinal torácico a nivel o cerca del foramen, la radiofrecuencia del ganglio de la raíz dorsal (GRD) puede ser una alternativa para obtener analgesia [22].
El autor prefiere radiofrecuencia pulsada en vez de lesión termal del GRD (23).
Figura 6. Tumor (asterisco) comprime nervio espinal a nivel de foramen izquierdo a nivel T9 (flecha) (33).
Neurólisis intratecal
El bloqueo neurolítico intratecal es un procedimiento intervencionista para el tratamiento del dolor del cáncer refractario que implica la inyección de agentes químicos en el espacio subaracnoideo, habitualmente fenol o alcohol (24).
Dado los riesgos de complicaciones graves y la posibilidad de desencadenar dolor por desaferentación, es un recurso excepcional en pacientes con expectativa de vida menor a 6 meses, con dolor bien localizado y que no ha sido posible controlar con dosis altas de opioides (25).
La tasa de complicaciones permanentes de la neurolisis intratecal oscila entre 1-13% e incluyen incontinencia urinaria o fecal, debilidad de las extremidades, parestesia dolorosa, aracnoiditis, trombosis de las arterias espinales y muerte, especialmente si el químico se propaga más allá del sitio de la neurolisis (26). Las complicaciones transitorias incluyen dolor de cabeza, debilidad, entumecimiento y problemas del esfínter y son frecuentes con una tasa de hasta un 71% (26).
Ahmed et al (27) publicó una serie de 30 pacientes con cáncer pulmonar utilizando Fenol al 6% en glicerina, en dosis de 0,1 ml por metámero hasta un volumen máximo de 0,5 ml en mujeres y 0,7 ml en hombres en posición decúbito 45° con área a bloquear abajo y manteniendo esa posición por 45 minutos. El EVA disminuyó desde 8,07+0,91 (Media+DS) a 2,27+0,58 al día siguiente y se mantuvo hasta los 3 meses de seguimiento en un EVA disminuido de 2,53+0,97 (27). No se reportaron complicaciones.
Manejo Intervencional del dolor de la plexopatía braquial maligna
La compresión del plexo braquial por el tumor o los linfonodos tumorales produce un dolor de tipo neuropático severo asociado a compromiso motor y disminución de la fuerza y movilidad del hombro y brazo y linfedema asociado. Según el autor, el intervencionismo debe realizarse simultáneamente sobre el sistema simpático cervicotorácico y sobre el plexo braquial. El acceso cervical a las raíces del plexo braquial y al ganglio estrellado puede ser difícil por la presencia de las masas tumorales y la vía paravertebral posterior puede ser una alternativa (28).
En primera instancia el autor infiltra con corticoides las raíces y el ganglio estrellado (29).
Si la respuesta analgésica es insuficiente se le ofrece al paciente la neurolisis del plexo braquial y del ganglio estrellado con alcohol o fenol, advirtiendo la plejia secundaria de la extremidad (30-32).
Manejo Intervencional del dolor de las metástasis vertebrales
El dolor por las metástasis óseas puede estar relacionado con una combinación de inestabilidad y/o fractura vertebral, estiramiento perióstico, lisis tisular, e invasión del canal medular y/o neuroforaminal como consecuencia de las lesiones metastásicas. En caso de invasión del canal medular con compresión medular se debe realizar cirugía descompresiva más radioterapia (RT). Sin la urgencia de la compresión medular, las cirugías de columna presentan un alto riesgo en estos pacientes debido a compromiso de su estado general (performance estatus disminuido), caquexia, inmunodepresión, baja cicatrización con hueso de mala calidad, y disminución de la esperanza de vida. Por ello se han propuestos procedimientos mínimamente invasivos para el control del dolor y la calidad de vida de los pacientes con metástasis vertebrales. Las guías de práctica clínica publicadas recomiendan Vertebroplastia a nivel de columna torácica (Recomendación Positiva para vertebroplastias 2B+) (33-35).
En casos de riesgo de extravasación del cemento hacia el espacio peridural con el riesgo de compresión medular, el dolor por la metástasis vertebral se puede manejar con radiofrecuencia de los ganglios de las raíces dorsales torácicas (36). Los autores (36) mostraron que la radiofrecuencia termal (dos ciclos a 80°C durante 90 segundos) mantenía la disminución del EVA a los tres meses en comparación con radiofrecuencia pulsada y corticoides.
Algoritmo de tratamiento
Gulati et al (37) han propuesto un algoritmo de tratamientoi ntervencional del dolor torácico oncológico tomando en consideración la ubicación del tumor, si el tumor invade los nervios espinales, o si el tumor invade el espacio peridural. Si el tumor está ubicado en la pared torácica media o anterior, Gulati et al plantea el manejo con bloqueos de nervios intercostales; si el tumor está ubicado en la pared posterior propone realizar bloqueos paravertebrales; si hay invasión del tumor de los nervios espinales torácicos se propone radiofrecuencia de los ganglios dorsales torácicos; si hay invasión peridural, implantación de bomba de infusión intratecal de morfina.
Medicina Intervencional y oncología
Hasta ahora las terapias intervencionales se han considerado como un último recurso para aliviar el dolor del cáncer en aquellos pacientes donde las terapias farmacológicas convencionales no han logrado controlar razonablemente el dolor. Diversos autores coinciden en que las terapias intervencionales en etapas tempranas en pacientes con dolor no controlado mejoran su condición de salud, mejoran su rendimiento para enfrentar la enfermedad y su tratamiento, y evitan o retrasan la escalada de opioides con sus efectos adversos asociados (38). Se requiere un trabajo en conjunto con oncólogos para poder identificar qué pacientes presentan dolor severo no controlado y que se podrían beneficiar de terapias intervencionales (38).
Conclusión
El dolor es un síntoma frecuente de presentación en los casos de cáncer pulmonar y es un dolor refractario debido a la multiplicidad de generadores de dolor. Las presentaciones pueden ser una invasión pleural, metástasis costales, invasión mixta o síndrome costo-pleural, tumor de Pancoast, y metástasis vertebral con o sin invasión paravertebral. Se han desarrollado terapias intervencionales mínimamente invasivas para tratar el dolor, que en etapas tempranas en pacientes con dolor no controlado mejoran su condición de salud, mejoran su rendimiento para enfrentar la enfermedad y su tratamiento, y evitan o retrasan la escalada de opioides con sus efectos adversos asociados. Se requiere estandarizar las técnicas, mejorar la calidad de los ensayos clínicos y desarrollar guías de práctica clínica en un trabajo conjunto con oncología.“disminuyen los sesgos y son herramientas que ayudan o empujan al cambio personal y colectivo” (Cerezo, 2020, p.430). Este “pequeño empujón” que actúa a partir de reconfigurar la arquitectura de la decisión, implica una estrategia o modelo de intervención que busca mejorar la efectividad de las políticas públicas de modo de alcanzar los objetivos por ellas mismas planteados. Se denominan tecnologías de políticas públicas que buscan incrementar la eficiencia y, en consecuencia, los niveles de confianza y cooperación (Güemes, 2017; Sunstein & Thaler, (2017).
En Chile, en el estudio de la Pontificia Universidad Católica de Chile (2017), se enfatiza que la propuesta debe ser desde un “enfoque centrado en el paciente, que persiga mejoras de equidad en el acceso y que responda primariamente al dolor crónico musculoesquelético como problema de salud y no únicamente a las causas que le subyacen” (Espinoza et.al., 2017, p.20)
Conflicto de Intereses
Autor(es) no declaran conflicto de interés en el presente trabajo.
Referencias Bibliográficas
- Watson PN, Evans RJ. Intractable pain with lung cancer. Pain 1987;29:163-73.
- Watson P, Evans R. Intractable pain with lung cancer. Pain 1987; 29:163-173.
- Wood J, Gawler J, Whittle RJ, Staunton MD. Brachial plexopathy in breast carcinoma-an unsolved problem. Eur J SurgOncol 1991; 17:265-269.
- Khosravi Shahi P. Síndrome de Pancoast (tumor de sulcus pulmonar superior): revisión de la literatura. An Med Interna (Madrid) 2005; 22:194-196.
- Malignant brachial plexopathy: A pictorial essay of MRI findings. VR Iyer, DA Sanghvi, N Merchant. Indian Journal of Radiology and Imaging 2010;20(04):274-278.
- Cahueque-Lemus, M. A., Cobar-Bustamante, A. E., Bregni-Duraés, M. C., & Jiménez-Ávila, J. M. (2018). Síndrome de destrucción vertebral: del entendimiento a la práctica. Acta ortopédica mexicana, 32(3),182-187.
- Karmakar MK, Ho A. Postthoracotomy pain syndrome. Thorac Surg Clin 2004; 14:345-352.
- Hazelrigg SR, Cetindag IB, Fullerton J. Acute and chronic pain syndromes after thoracic surgery. Surg Clin North Am 2002; 82: 849-65.
- Wisotzky EM, Saini V, Kao C. Ultrasound-guided intercostobrachial nerve block for intercostobrachial neuralgia in breast cancer patients: a case series. PMR 2016;8:273-277.
- Wijayasinghe, N., Duriaud, H. M., Kehlet, H., Andersen, K. G., & Anderson, K. G. (2016). Ultrasound guided intercostobrachial nerve blockade in patients with persistent pain after breast cancer surgery: a pilot study. Pain Physician, 19(2), E309-18.
- Mercadante S, Vitrano V. Pain in patients with lung cancer: Pathophysiology and treatment. Lung Cancer 2010 Apr;68(1):10-5.
- Wong FC, Lee TW, Yuen KK, et al. Intercostal nerve blockade for cancer pain: Effectiveness and selection of patients. Hong Kong Med J 2007 Aug;13(4):266-70.
- Kowalewski R, Schurch B, Hodler J, Borgeat A. Persistent paraplegia after an aqueous 7.5% phenol solution to the anterior motor root for intercostal neurolysis: a case report. Arch Phys Med Rehabil. 2002;83:283-5.
- Kissoon NR, Graff-Raddford J, Watson JC, Laughlin RS. Spinal cord injury from fluoroscopically guided intercostal blocks with phenol. Pain Physician 2014;17:E219-24.
- Gollapalli L, Muppuri R. Paraplegia after intercostal neurolysis with phenol. J Pain Res. 2014;7:665-8.
- Kim BH, No MY, Han SJ, Park CH, Kim JH. Paraplegia following intercostal nerve neurolysis with alcohol and thoracic epidural injection in lung cancer patient. Korean J Pain. 2015;28:148-52.
- Forero M, Adhikary SD, Lopez H, Tsui C, Chin KJ. The Erector Spinae Plane Block: A Novel Analgesic Technique in Thoracic Neuropathic Pain. Reg Anesth Pain Med. 2016 Sep-Oct;41(5):621-7.
- Choi YJ, Kwon HJ, O J, Cho TH, Won JY, Yang HM. et al. Influence of injectate volume on paravertebral spread in erector spinae plane block: An endoscopic and anatomical evaluation. PLoS One. 2019;14(10):e0224487.
- Ramos, J., Peng, P. & Forero, M. Long-term continuous erector spinae plane block for palliative pain control in a patient with pleural mesothelioma. Can J Anesth/J Can Anesth 2018;65:852-853.
- Hernandez-Porras BC, Rocha A, Juarez AM. Phenol spread in erector spinae plane block for cancer pain. Reg Anesth Pain Med 2019. DOI: https://doi.org/10.1136/rapm-2019-100509.
- Oh TK, Kim NW, Yim J, Lim H, Park B, Kim DH. Effect of Radiofrequency Thermocoagulation of Thoracic Nerve Roots in Patients with Cancer and Intractable Chest Wall Pain. Pain Physician. 2018 Jul;21(4):E323-E329.
- Cohen SP, Sireci A, Wu CL, et al. Pulsed radiofrequency of the dorsal root ganglia is superior to pharmacotherapy or pulsed radiofrequency of the intercostal nerves in the treatment of chronic postsurgical thoracic pain. Pain Physician 2006 Jul;9(3):227-35.
- Malik K, Benzon HT, Khalid Malik. Radiofrequency applications to dorsal root ganglia. Anesthesiology 2008;109:527-542.
- Candido K, Stevens RA. Intrathecal neurolytic blocks for the relief of cancer pain. Best Pract Res Clin Anaesthesiol 2003;17:408-28.
- Watanabe A, Yamakage M. Intrathecal neurolytic block in a patient with refractory cancer pain. J Anesth 2011;25:603-605.
- Woodford R, & Curley D. Revisiting intrathecal neurolysis for refractory cancer pain: A case series. Progress in Palliative Care 2020;28:6:366-368, DOI:10 .1080/09699260.2020.1814062
- Ahmed FA, Raafat RM, Emad GS, Somaya AE, Mohga AS. Chemical Dorsal Rhizotomy in Lung Cancer Pain. The Medical Journal of Cairo University 2021;89(6):1283-1288. DOI: 10.21608/mjcu.2021.185037
- Peláez R, Pascual G, Aguilar JL, Atanassoff PG. Paravertebral cervical nerve block in a patient suffering from a Pancoast tumor. Pain Med. 2010 Dec;11(12):1799-802.
- Zinboonyahgoon N, Vlassakov K, Abrecht CR, Srinivasan S, Narang S. Brachial Plexus Block for Cancer-Related Pain: A Case Series. Pain Physician. 2015 Sep-Oct;18(5):E917-24.
- Mullin V. Brachial plexus block with phenol for painful arm associated with Pancoast's syndrome. Anesthesiology. 1980 Nov;53(5):431-3.
- Loh TH, Patel S, Mirchandani A, Eckmann M. Brachial Plexus Chemical Neurolysis with Ethanol for Cancer Pain. Case Rep Med. 2018 Jul 24;2018:8628645.
- Jain D, Goyal T, Paswan AK, Verma N. Sequential Supraclavicular Brachial Plexus and Stellate Ganglion Neurolysis for Upper Limb Pain in Metastatic Breast Cancer. Indian J Palliat Care. 2021 Jan-Mar;27(1):180-182.
- Bhatnagar S, & Gupta M. Evidence-based clinical practice guidelines for interventional pain management in cancer pain. Indian journal of palliative care 2015;21(2):137.
- Ahmed A, Thota RS, Chatterjee A, Jain P, Ramanjulu R, Bhatnagar S, ... & Bhattacharya D. The Indian Society for Study of Pain, Cancer Pain Special Interest Group guidelines on interventional management for cancer pain. Indian Journal of Pain 2019;33(4):42.
- Sayed D, Jacobs D, Sowder T, Haines D, Orr W. Spinal Radiofrequency Ablation Combined with Cement Augmentation for Painful Spinal Vertebral Metastasis: A Single-Center Prospective Study. Pain Physician. 2019 Sep;22(5):E441-E449. PMID: 31561656.
- FanousSN,SalehEG,AbdElghafarEM,GhobrialHZ.Randomizedcontrolled trials between dorsal root ganglion thermal radiofrequency, pulsed radiofrequency and steroids for the management of intractable metastatic back pain in thoracic vertebral body. Br J Pain. 2021 Aug;15(3):270-281.
- Gulati A, Shah R, Puttanniah V, Hung JC, Malhotra V. A retrospective review and treatment paradigm of interventional therapies for patients suffering from intractable thoracic chest wall pain in the oncologic population. Pain Med. 2015 Apr;16(4):802-10.
- Hochberg U, Elgueta MF, Perez J. Interventional Analgesic Management of Lung Cancer Pain. Front Oncol. 2017 Feb 14;7:17. doi: 10.3389/fonc.2017.00017.