Etiquetas
#pandemia #COVID-19 #triaje #toma de decisiones #comorbilidades #cuidados paliativos #Dolor crónico #Neurocirugía #Síndrome de Fracaso de Cirugía Espinal Lumbar #anestesia espinal unilateral #dosis mínima #lateralización #cirugía traumatológica ambulatoria #nervio pudendo #neuralgia #radiofrecuencia pulsada; ultrasonido. #dolor #dolor neuropatico #topiramato #dolor agudo postquirúrgico #dolor incisiona #anestesia #niños #dolor agudo #dolor quirurgico #modelos y teorias #enfermeria #noticias #Investigación en Servicios de Salud #Rehabilitación #ansiedad #emociones #miedo #tristeza #Parche #Buprenorfina #Fentanilo #problemas sociales #síndrome pediátrico inflamatorio multisistémico #fibromialgia #narrativas #experiencia #Afrontamiento #estados emocionales #dolor de espalda #Cuidado paliativo #opioidesRevista El Dolor 77 | Noviembre 2024 - Año 34 | Revisión
Síndrome de dolor crónico posterior a cirugía torácica. Estrategias para reducir su incidencia
Aceptado: 21-08-2024
Páginas 34-39
Vizcarra, Keyla(1), Contreras-Domínguez, Víctor(2), Carbonell-Bellolio Paulina(3), Galleguillos, Gustavo(4)
(1) Residente de Anestesiología, Universidad de Concepción, Chile.
(2) MSc, MBA, PhD. Profesor asociado, Departamento de Cirugía, Universidad de Concepción, Chile
(3) MBA. Médico Anestesiólogo, Hospital Regional de Concepción, Chile.
(4) Anestesiólogo Cardiovascular, Hospital Regional de Concepción, Chile.
Resumen
El dolor crónico posterior a cirugía torácica es una entidad frecuente, pudiendo llegar a afectar a un 60% de los pacientes sometidos a este tipo de cirugías, con el consiguiente deterioro en su calidad de vida. El principal factor de riesgo para la aparición de éste es la presencia y severidad del dolor agudo postquirúrgico; por lo cual, es de vital importancia la prevención y el tratamiento eficaz de este último. Es por esta razón que la implementación de estrategias para el manejo del dolor agudo, tales como la analgesia multimodal y la analgesia preventiva, juegan un rol importante en el manejo de estos pacientes. Dentro del manejo podemos destacar también el uso de técnicas de analgesia neuroaxial, como la analgesia epidural torácica y técnicas de analgesia regionales, como el bloqueo paravertebral, bloqueos intercostales y los bloqueos del plano o miofascial. La analgesia regional ha cobrado gran interés en los últimos años debido a una eficacia comparable a la anestesia epidural torácica, pero con menos efectos adversos y complicaciones. Finalmente, el uso adecuado y criterioso de las técnicas antes señaladas permitirán un manejo exitoso de nuestros pacientes.
Palabras claves: Dolor Crónico, Cirugía Torácica.
Abstract
Chronic pain after thoracic surgery is a frequent entity, affecting up to 60% of patients undergoing this type of surgery, with the consequent deterioration in their quality of life. The main risk factor for the appearance of this is the presence and severity of acute post-surgical pain; Therefore, the prevention and effective treatment of the latter is of vital importance. For this reason, the implementation of strategies for the management of acute pain, such as multimodal analgesia and preventive analgesia, play an important role in the management of these patients. Within management we can also highlight the use of neuraxial analgesia techniques, such as thoracic epidural analgesia and regional analgesia techniques such as paravertebral block, intercostal blocks and plane or myofascial blocks. Regional analgesia has gained great interest in recent years due to efficacy comparable to thoracic epidural anesthesia, but with fewer adverse effects and complications. Finally, the proper and judicious use of the techniques will allow a successful management of our patients.
Keys words: Chronic Pain, thoracic surgery.
Introducción
El dolor persistente o dolor crónico post operatorio (DCPO) es aquel que aparece después de un procedimiento quirúrgico y que persiste por más de 3 meses o por más tiempo del esperado (1). Corresponde a un problema reconocido posterior a la cirugía torácica, con una alta incidencia, la que oscila entre un 30 a 60%, de acuerdo con diferentes estudios (2)(3)(4)(5). Esta situación genera un deterioro importante en la calidad de vida de los pacientes.
La cirugía torácica es considerada una de las intervenciones más dolorosas; siendo su etiología de carácter multifactorial, debido a que el dolor puede ser producido por la incisión quirúrgica como por la manipulación de las estructuras de la pared torácica tales como las costillas, músculos, nervios, órganos intratorácicos y también por la instalación de tubos de drenaje (6)(7). La presencia del dolor neuropático post cirugía torácica genera dificultades e incapacidad en los pacientes (8).
Dentro de los factores de riesgo para el desarrollo del dolor crónico post quirúrgico, el más importante es el dolor agudo moderado a severo, habitualmente con un manejo sub óptimo, el que suele aparecer en las primeras 72 horas posterior al procedimiento. Por ende, es fundamental realizar un plan anestésico/analgésico preventivo (2) (3).
La técnica analgésica de excelencia (“Gold standard”) para el manejo del dolor post operatorio en la cirugía torácica sigue siendo la analgesia epidural torácica (AET); pero cada vez más se emplean nuevas técnicas promisorias y con buenos resultados clínicos para el manejo del dolor agudo posoperatorio; las que a la vez presentan menos efectos adversos; que a su vez son más sencillas de realizar como, por ejemplo, el bloqueo paravertebral, que se ha convertido en una técnica satisfactoria y comparable a la AET.
En este artículo revisaremos la incidencia, factores de riesgo y estrategias preventivas de dolor crónico post operatorio en cirugía torácica.
Incidencia:
La incidencia del DCPO posterior a cirugía torácica no presenta diferencia significativa entre la cirugía por toracotomía y por toracoscopia, ambas fluctúan entre el 30- 60% de los casos (4) (5).
El DCPO post toracotomía presenta una incidencia del 47- 57% a los 3 meses desde la cirugía, y de un 33-47% a los 6 meses (4) (5)
El DCPO posterior a toracoscopia presenta una incidencia que oscila entre un 29% a los 3 meses y un 25% a los 6 meses post procedimiento (5).
Factores de riesgo:
Existen variados factores de riesgo del DCPO, los cuales pueden ser factores de riesgo asociados a características propias de los pacientes, tales como: edad joven, sexo femenino, dolor preexistente, factores psicosociales como la ansiedad, depresión, estrés, apoyo social deficiente, miedo al dolor y a la cirugía. Y factores inherentes al riesgo de la cirugía propiamente tal, entre los que podemos mencionar tipo, extensión, tiempo quirúrgico, daño nervioso intraoperatorio e intensidad del dolor post operatorio agudo (2)(9)(10). Sin embargo, en el caso particular de la cirugía torácica se reconoce como factor de riesgo más importante al dolor agudo postoperatorio moderado a severo (2). Otros factores de riesgo que podrían tener relación con la aparición de DCPO son factores relacionados con el paciente, como el sexo femenino y características psicosociales, sin embargo, existe controversia sobre estos últimos (2) (5) (10).
En un estudio realizado por Ross et al. (11), se identificaron factores asociados a altas tasas de dolor agudo post operatorio, entre ellos: edad joven, uso crónico de opioides, uso de talco y múltiples puertos de acceso para una videotoracoscopia. También se identificaron factores de riesgo independiente de dolor crónico post operatorio como: historial de patologías psiquiátricas, cirugía de urgencia y uso de tramadol en el postoperatorio.
Manejo anestésico:
El factor de riesgo principal para desarrollar DCPO tras una cirugía torácica es la presencia de dolor agudo de moderado a severo en el periodo postoperatorio, por lo que es importante planificar una estrategia adecuada para la prevención y tratamiento de éste.
La analgesia multimodal es aquella en la cual se utilizan dos o más analgésicos administrados a través de mecanismos o modalidades diferentes para proporcionar analgesia postoperatoria (12).
La analgesia preventiva y la analgesia multimodal ayudan a mejorar el dolor postoperatorio, además de disminuir el requerimiento de opioides intraoperatorio y, por lo tanto, sus efectos adversos (12).
En un estudio realizado por Bernal et al. (13) se comparó el dolor postoperatorio en cirugía de tórax entre pacientes sometidos a anestesia combinada más analgesia multimodal y anestesia general, sin bloqueo regional; demostrándose mayor necesidad de rescate analgésico en el postoperatorio en este último grupo, además de mayor estadía hospitalaria, la que se vio extendida en 2 días en comparación a la técnica multimodal.
Prevención Farmacológica:
La analgesia preventiva es aquella que se administra previo a la incisión quirúrgica y entre las técnicas encontramos la administración de medicamentos antinflamatorios, como AINES y corticoides; antagonistas del receptor NMDA (ácido N-Metil-D-Aspártico), como ketamina; anticonvulsivantes, como pregabalina, y agonistas alfa-2 selectivos, como la dexmedetomidina (1).
Los inhibidores de la coclooxigenasa-1 y ciclooxigenasa-2 son utilizados ampliamente dentro de la estrategia de analgesia multimodal, al igual que el uso de corticoides para la prevención de náuseas y vómitos post operatorios. Sin embargo, no hay evidencia sobre la prevención del dolor crónico postquirúrgico con el uso de estos fármacos (1).
La ketamina como inhibidor de los receptores NMDA podría ser beneficiosa en la prevención de dolor agudo y crónico al reducir la sensibilización al dolor central. Se utiliza generalmente como bomba de infusión durante la cirugía, obteniendo mejores resultados que como analgesia controlada por el paciente (1).
La dexmedetomidina también, utilizada con frecuencia en el intraoperatorio como infusión, podría tener un papel importante en la prevención de dolor post operatorio por su acción sobre receptores alfa-2 a nivel central. Sin embargo, existen diferentes estudios en los cuales los resultados son contradictorios en cuanto a la prevención del DCPO, tanto para la ketamina, como también para la dexmedetomidina (1). Un estudio realizado por Mena et al. (14) concluyó que el uso de s-ketamina durante el intraoperatorio en video toracoscopia presentaba resultados favorables en cuanto a la recuperación y manejo del dolor post operatorio. Sin embargo, otro estudio en que se comparó el uso de ketamina y dexmedetomidina en infusión en cirugía torácica no demostró diferencias comparado con uso de opioides endovenosos (15).
La pregabalina es un fármaco recomendado para el tratamiento del dolor neuropático (16). Estructuralmente es considerada un análogo del neurotransmisor GABA (acido gaba aminobutírico) y su mecanismo de acción es a través de la interacción con la subunidad α-2-δ de los canales de calcio dependientes de voltaje en el sistema nervioso central, lo que se traduce en disminución de la hiperexcitabilidad neuronal (16); es por esta razón que el uso de pregabalina podría tener un rol importante en la prevención del dolor crónico. Así lo demuestra un estudio realizado por Gabert et al. (17), en que se comparó el uso de pregabalina en dosis de 150 mg vía oral cada 12 horas, iniciada 12 horas previo a la cirugía y hasta el quinto día post toracotomía.Se concluyó que ésta es efectiva en la reducción del dolor neuropático crónico a los 1,2 y 3 meses post toracotomía. Sin embargo, otros estudios han demostrado buenos resultados en la prevención del dolor neuropático postoperatorio en dosis mucho menores, tales como 50 mg al día (18). Además, la pregabalina ha demostrado ser un fármaco eficaz y comparable con la analgesia epidural para la prevención del dolor agudo post cirugía torácica y con menos efectos adversos (19) (20).
Analgesia neuroaxial:
La analgesia epidural torácica (AET) con anestésicos locales con y sin coadyuvantes como los opioides ha sido considerada por largo tiempo como el gold standard para controlar de forma efectiva el dolor post operatorio en la cirugía torácica (21) (22).
Sin embargo, la AET es considerada como un procedimiento invasivo y de alta complejidad, incluso en anestesiólogos experimentos; no estando exenta de complicaciones derivadas de la técnica, como a la vez, a reacciones adversas a los fármacos utilizados. Entre las complicaciones de la AET se describen hipotensión, náuseas y vómitos, hematoma epidural y daño neurológico transitorio y/o permanente entre otras (22)(23). Es por esta razón que en el último tiempo se han buscado otras alternativas terapéuticas, menos invasivas para el tratamiento del dolor agudo secundario a una toracotomía y/o toracoscopia.
Técnicas de analgesia loco regionales:
Para efectuar técnicas de analgesia regional en la cirugía torácica hay que tener conocimientos de la anatomía de la pared del tórax y su inervación. Los bloqueos regionales consideran el trayecto de los nervios torácicos espinales que realizan dentro de la pared torácica; éstos emergen desde los agujeros intervertebrales y se dividen en los ramos anteriores y posteriores, los que van a dar inervación a los músculos, articulaciones y piel de la región ventral y dorsal del tórax, respectivamente. Los ramos anteriores se denominan nervios intercostales por su recorrido en el espacio intercostal (24).
Dentro de los bloqueos regionales utilizados para la pared torácica se encuentran bloqueos tales como el paravertebral, bloqueos intercostales y los bloqueos del plano miofascial (25).
El bloqueo paravertebral (BPV) consiste en inyectar anestésico local en el espacio paravertebral en uno o más niveles, puede ser realizado por reparo anatómico o bajo guía ecográfica. Proporciona bloqueo unilateral y menos compromiso hemodinámico que la epidural torácica (25) (26).
Un metaanálisis que comparó la AET y el BPV demostró que ambas técnicas tienen eficacias comparables en cuanto al tratamiento del dolor agudo post operatorio. Sin embargo, estudios controlados y aleatorizados más recientes han demostrado menor eficacia en el alivio del dolor agudo post operatorio, así como también en la prevención del dolor crónico post toracotomía a los 3 y 12 meses (27). Aun así, el bloqueo paravertebral se sigue asociando a menos complicaciones que la epidural torácica, una técnica de realización más fácil y sigue siendo de elección cuando esta última está contraindicada (1) (26).
El bloqueo de los nervios intercostales está dirigido a las raíces anteriores y posteriores, es realizado por el cirujano antes de cerrar el esternón, mediante la inyección de anestésico local directamente en los espacios intercostales. Tiene la particularidad de ser un bloqueo seguro y preciso ya que se realiza bajo visión directa de la zona de inyección, por lo tanto, es de utilidad si no se cuenta con la disponibilidad de ecografía y cuando existe contraindicación del AET o BPV (28). Además, presenta una eficacia comparable al bloqueo paravertebral en cuanto al tratamiento del dolor agudo; pero no se ha demostrado su rol en la prevención del dolor crónico post cirugía torácica (28) (29).
Dentro de los bloqueos del plano miofascial torácico encontramos el bloqueo retro laminar (BRL), en el cual se realiza la administración de un anestésico local, aproximadamente a 1 cm del plano sagital, entre la lámina de las vértebras torácicas y los músculos para espinales. Es un bloqueo de tipo interfascial y ejerce su acción al bloquear las ramas cutáneas laterales de los nervios intercostales al alcanzar por diseminación el espacio paravertebral (30)(31). Si bien presenta un buen rendimiento en cuanto al manejo del dolor agudo posoperatorio, no sería comparable al BPV (25) (30).
El bloqueo del plano del músculo erector de la columna (ESPB, por sus siglas en inglés) de forma similar al BRL, logra su acción con la diseminación del anestésico local hasta el espacio paravertebral, donde bloquea las ramas dorsales y ventrales de los nervios espinales. Bajo visión ecográfica se inyecta la solución anestésica entre el músculo erector de la columna y el extremo lateral de las apófisis transversas, generalmente a nivel de t4-t5. Es un bloqueo seguro, con menos efectos adversos y complicaciones, ya que la zona de inyección se encuentra alejada de pleura, pulmones y médula espinal (30) (32). Fue descrito por Forero et al., en el año 2016 (33), como analgesia para fracturas costales y en contexto de dolor neuropático; posteriormente se incluyó dentro del manejo del dolor para toracotomías y cirugías mamarias (31) (32).
Varios estudios y series de casos describen este bloqueo como una técnica eficaz para el manejo del dolor post toracoscopia; además de ser fácil de realizar, podría ser una alternativa a la EAT y al BPV (34)(35)(36), ya que se relaciona con una reducción significativa del dolor post operatorio y un uso menor de opioides en este periodo (37) (38) (39).
El bloqueo de los nervios pectorales (PECS) se describió inicialmente como una alternativa analgésica para cirugía mamaria, por Blanco en 2011 (40). Se distinguen dos bloqueos nerviosos diferentes que se realizan bajo ecografía: el PECS I, que se administra anestésico local entre el pectoral mayor y el pectoral menor con el objetivo de bloquear los nervios pectoral medial y lateral; y el PECS II que busca administrar anestésico local en dos sitios diferentes con una sola inyección: entre los músculos pectoral mayor y menor y la segunda entre el músculo pectoral menor y músculo serrato anterior, así se logran bloquear los nervios intercostales superiores, nervio torácico largo y el nervio intercostobraquial de forma adicional (25) (30) (32). El PECS representa una buena alternativa para cirugías de cáncer de mama y aumento mamario (41) (42), también tiene buenos resultados en procedimientos de implantación de dispositivos electrónicos cardiovasculares, como desfibriladores y marcapasos (43). Sin embargo, no demostró ser equivalente a analgesia intravenosa en cirugía de injerto de derivación de arteria coronaria o cirugía de válvula coronaria a través de esternotomía media (44).
El bloqueo del plano anterior del serrato es un bloqueo interfascial eco-guiado que busca bloquear la pared anterolateral del tórax. Se puede realizar en el plano superficial o profundo del músculo serrato anterior; este último produciría un efecto más duradero y mayor tasa de éxito (25)(32)(43)(45). Se ha demostrado su eficacia en cirugía torácica con buen efecto sobre el dolor post operatorio con menos uso de opioides, una duración mayor que el bloqueo intercostal, pero menor que el BPV (25,42). Sin embargo, representa una buena alternativa debido a que presenta baja incidencia de complicaciones y mínimos cambios hemodinámicos durante cirugía cardiaca (42)(46).
El bloqueo en el plano del músculo transverso torácico es una técnica que se desarrolló en el año 2015 por Ueshima et al. (47); busca otorgar analgesia a la pared anterior del tórax al bloquear las ramas anteriores de los nervios intercostales. El objetivo de esta técnica es depositar un anestésico local en el plano interfascial de los músculos intercostales internos y el músculo transverso del tórax bajo visión ecográfica (25) (47) (48). Es de utilidad en cirugía cardíaca para el manejo del dolor postoperatorio a la esternotomía cuando se realiza un bloqueo bilateral; como también, es una buena opción para pacientes que se someterán a una mastectomía cuando se combina con el bloqueo PECS (25)(49). Estudios han demostrado que es un bloqueo prometedor en cuanto al manejo del dolor agudo postcirugía torácica, más específicamente, post esternotomía. Sin embargo, no se ha demostrado un rol dentro de la prevención del dolor crónico (49) (50) (51).
Otra forma de proveer analgesia postoperatoria es la instilación continua de un anestésico local a través de un catéter insertado en la herida operatoria (52). Si bien es una técnica conocida en diferentes tipos de intervenciones, en cirugía cardiaca con esternotomía completa ha mostrado resultados dispares (25). En un estudio realizado por Mattila et al. (53), se investigó el efecto de la infusión continua de ropivacaína en la herida operatoria sobre el dolor postoperatorio después de esternotomía mediana y drenaje mediastínico en niños. No hubo diferencias significativas en el uso de morfina a las 24, 48 y 72 horas. post cirugía y tampoco en las escalas de dolor y en la aparición de náuseas y vómitos post operatorios. En contraste, un estudio realizado por Jang et al. (54), comparó el efecto analgésico de la infusión continua en la herida asociado a analgesia intravenosa controlada por el paciente (PCA) versus PCA sola, demostrando que la combinación de ambas presenta mejores resultados que PCA sola en cuanto al dolor postoperatorio y menos efectos adversos; pero no logró demostrar diferencias en la incidencia de aparición del DCPO post cirugía torácica.
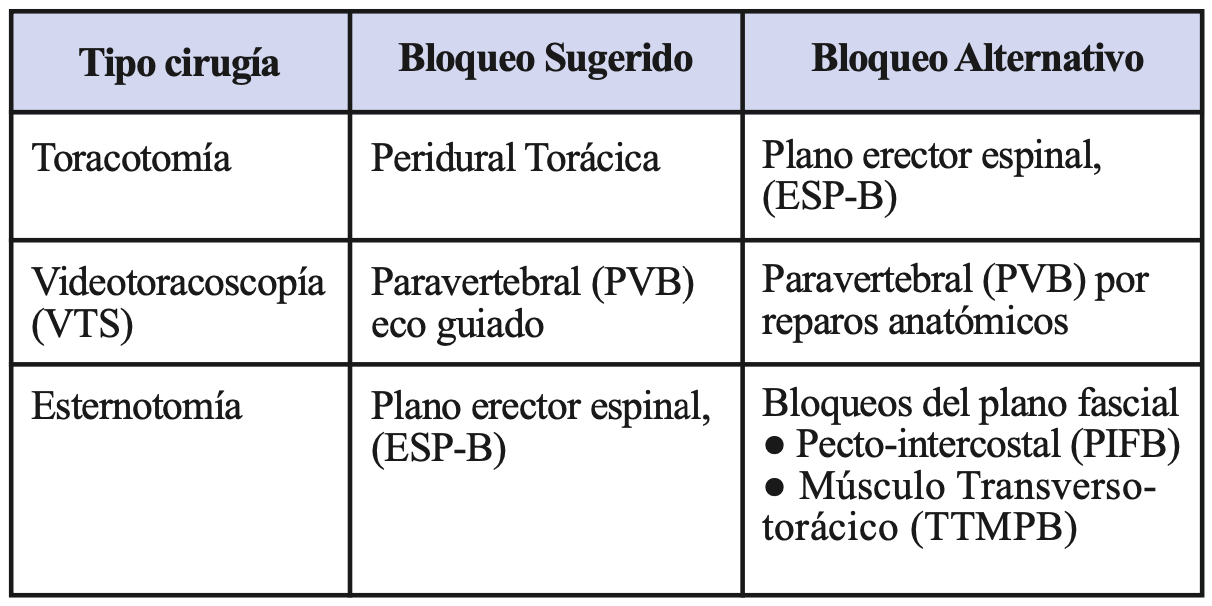
En la Tabla 1 se presenta un resumen de las diferentes técnicas de analgesia sugeridas como de primera elección y su alternativa, para optimizar el manejo del dolor agudo post quirúrgico en pacientes beneficiarios de una cirugía torácica.
Tabla 1: Tipos de bloqueo analgésico según tipo de cirugía torácica realizada.
Conclusión
El dolor postoperatorio, tanto agudo como crónico, es un problema relevante tras la cirugía torácica. La presencia de dolor agudo post operatorio es el factor de riesgo más importante en la génesis del dolor crónico posterior a la cirugía torácica; por lo que las estrategias preventivas, como también, la implementación de aquellas técnicas de analgesia regional que han demostrado ser útiles para tratar y prevenir estas dos entidades deben cobrar un rol principal en el manejo anestesiológico de este tipo de pacientes. En manejo optimo del dolor agudo post cirugía torácica, especialmente en pacientes con factores de riesgo asociados para desarrollar DCPO, es la clave para reducir la incidencia de este último, el cual puede causar gran incomodidad al paciente, afectando de manera importante su calidad de vida a futuro.
Conflicto de Intereses
Autor (es) no declaran conflicto de interés en el presente trabajo.
Referencias Bibliográficas
- Richebé P, Capdevila X, Rivat C. Persistent Postsurgical Pain: Pathophysiology and Preventative Pharmacologic Considerations. Anesthesiology. 2018 Sep;129(3):590-607. https://doi.org/10.1097/ALN.0000000000002238. PMID: 29738328.
- Niraj G, Kelkar A, Kaushik V, Tang Y, Fleet D, Tait F, et al. Audit of postoperative pain management after open thoracotomy and the incidence of chronic postthoracotomy pain in more than 500 patients at a tertiary center. J Clin Anesth. 2017 Feb;36:174–7. https://doi.org/10.1016/j.jclinane.2016.10.011 PMID:28183561
- Fiorelli S, Cioffi L, Menna C, Ibrahim M, De Blasi RA, Rendina EA, et al. Chronic Pain After Lung Resection: Risk Factors, Neuropathic Pain, and Quality of Life. J Pain Symptom Manage. 2020 Aug;60(2):326-335. https://doi.org/10.1016/j.jpainsymman.2020.03.012. Epub 2020 Mar 24. PMID: 32220584.
- Bayman EO, Brennan TJ. Incidence and severity of chronic pain at 3 and 6 months after thoracotomy: meta-analysis. J Pain. 2014 Sep;15(9):887–97. https://doi.org/10.1016/j.jpain.2014.06.005 PMID:24968967
- Bayman EO, Parekh KR, Keech J, Selte A, Brennan TJ. A Prospective Study of Chronic Pain after Thoracic Surgery. Anesthesiology. 2017 May;126(5):938-951. https://doi.org/10.1097/ALN.0000000000001576. PMID: 28248713; PMCID: PMC539533.
- Hazelrigg SR, Cetindag IB, Fullerton J. Acute and chronic pain syndromes after thoracic surgery. Surg Clin North Am. 2002 Aug;82(4):849-65. https://doi.org/10.1016/s0039-6109(02)00031-2. PMID: 12472133.
- Campos JH, Seering M. Does the Analgesic Technique in the Intraoperative Period Have Any Influence on Chronic Pain after Uniportal Video-Assisted Thoracoscopic Surgery? J Cardiothorac Vasc Anesth. 2020 Apr;34(4):992-994. https://doi.org/10.1053/j.jvca.2019.11.050. Epub 2019 Dec 7. PMID: 31987737.
- Cattoni M, Rotolo N, Mastromarino MG, Cardillo G, Nosotti M, Mendogni P, et al. Chronic chest pain and paresthesia after video-assisted thoracoscopy for primary pneumothorax. J Thorac Dis. 2021 Feb;13(2):613-620. https://doi.org/10.21037/jtd-20-2860. PMID: 33717534; PMCID: PMC7947510.
- Fregoso G, Wang A, Tseng K, Wang J. Transition from Acute to Chronic Pain: Evaluating Risk for Chronic Postsurgical Pain. Pain Physician. 2019 Sep;22(5):479-488. PMID: 31561647.
- Petersen PL, Bredahl P, Perch M, Møller CH, Finnerup NB, Nikolajsen L. Chronic pain after bilateral thoracotomy in lung transplant patients. Scand J Pain. 2019 Apr 24;19(2):271-277. https://doi.org/10.1515/sjpain-2018-0126. PMID: 30835097.
- Ross JDW, Cole CMW, Lo W, Ura M. Postoperative Pain in Thoracic Surgical Patients: An Analysis of Factors Associated With Acute and Chronic Pain. Heart Lung Circ. 2021 Aug;30(8):1244-1250. https://doi.org/10.1016/j.hlc.2020.12.001. Epub 2021 Jan 15. PMID: 33461917.
- Huang CC, Sun WZ, Wong CS. Prevention of Chronic Postsurgical Pain: The Effect of Preventive and Multimodal Analgesia. Asian J Anesthesiol. 2018 Sep;56(3):74-82. https://doi.org/10.6859/aja.201809_56(3).0002. PMID: 30583329.
- Bernal BBC, Olivares MH, Tomás RC, Hernández RC, Rojas ZEM, Arriola CJ et al. Análisis comparativo de dolor postoperatorio de cirugía de tórax entre anestesia general y anestesia combinada más analgesia multimodal. An Med Asoc Med Hosp ABC. 2014;59(1):29-35.
- Xiang Cheng, Han Wang, Mengmeng Diao, Hao Jiao. Effect of S-ketamine on Postoperative Quality of Recovery in Patients Undergoing Video-Assisted Thoracic Surgery. Journal of Cardiothoracic and Vascular Anesthesia, Volume 36, Issue 8, Part B, 2022, Pages 3049-3056.
- Gabriel E. Mena, Andres Zorrilla-Vaca, Ara Vaporciyan, Reza Mehran, Javier D. Lasala, Wendell Williams, et al. Intraoperative Dexmedetomidine and Ketamine Infusions in an Enhanced Recovery After Thoracic Surgery Program: A Propensity Score Matched Analysis. Journal of Cardiothoracic and Vascular Anesthesia, Volume 36, Issue 4, 2022, Pages 1064-1072.
- Restrepo-Garcés C. E., Marrique-Valencia H., Botero-Posada L. F.. Gabapentina y Pregabalina: ¿cuál es su papel en el perioperatorio?. Rev. Soc. Esp. Dolor [Internet]. 2007 Ago [citado 2022 Nov 28] ; 14( 6 ): 432-436.
- Gaber S, Saleh E, Elshaikh S, Reyad R, Elramly M, Mourad I, et al. Role of Perioperative Pregabalin in the Management of Acute and Chronic Post-Thoracotomy Pain. Open Access Maced J Med Sci. 2019 Jun 30;7(12):1974-1978. https://doi.org/10.3889/oamjms.2019.556. PMID: 31406539; PMCID: PMC6684440.
- Homma T, Doki Y, Yamamoto Y, Ojima T, Shimada Y, Kitamura N, et al. Efficacy of 50 mg pregabalin for prevention of postoperative neuropathic pain after video-assisted thoracoscopic surgery and thoracotomy: a 3-month prospective randomized controlled trial. J Thorac Dis. 2019 Mar;11(3):694-701. https://doi.org/10.21037/jtd.2019.02.77. PMID: 31019756; PMCID: PMC6462706.
- Matsutani N, Dejima H, Nakayama T, Takahashi Y, Uehara H, Iinuma H, et al. Impact of pregabalin on early phase post-thoracotomy pain compared with epidural analgesia. J Thorac Dis. 2017 Oct;9(10):3766-3773. https://doi.org/10.21037/jtd.2017.09.78. PMID: 29268384; PMCID: PMC5723859.
- Mishra A, Nar AS, Bawa A, Kaur G, Bawa S, Mishra S. Pregabalin in Chronic Post-thoracotomy Pain. J Clin Diagn Res. 2013 Aug;7(8):1659-61. https://doi.org/10.7860/JCDR/2013/5707.3239. Epub 2013 Aug 1. PMID: 24086867; PMCID: PMC3782924.
- Sica A, Casale B, Sagnelli C, Di Dato MT, Rispoli M, Santagata M, et al. Chronic Chest Pain Control after Trans-Thoracic Biopsy in Mediastinal Lymphomas. Healthcare (Basel). 2021 May 18;9(5):589. https://doi.org/10.3390/healthcare9050589. PMID: 34069774; PMCID: PMC8157245.
- Yeung JH, Gates S, Naidu BV, Wilson MJ, Gao Smith F. Paravertebral block versus thoracic epidural for patients undergoing thoracotomy. The Cochrane database of systematic reviews. 2016; 2: Cd009121.
- Listing H, Pöpping D. PRO: Epiduralanalgesie – Goldstandard bei abdominalen und thorakalen Eingriffen [Pro: Epidural Analgesia Remains the Gold Standard for Abdominal and Thoracic Surgery]. Anasthesiol Intensivmed Notfallmed Schmerzther. 2018 Apr;53(4):237-244. German. https://doi.org/10.1055/s-0043-104668. Epub 2018 May 9. PMID: 29742783.
- Rouvière, H. Anatomía Humana Descriptiva, topográfica y funcional, 11a ed. ©2005 Últ. Reimpr. 2006.
- Polona Gams, Juš Kšela, Maja Šoštarič. Regional anesthesia for cardiothoracic surgery. Signa Vitae. 2022. https://doi.org/10.22514/sv.2022.064.
- Mijatovic D, Bhalla T, Farid I. Post-thoracotomy analgesia. Saudi J Anaesth. 2021 Jul-Sep;15(3):341-347. https://doi.org/10.4103/sja.SJA_743_20. Epub 2021 Jun 19. PMID: 34764841; PMCID: PMC8579496.
- Li XL, Zhang J, Wan L, Wang J. Efficacy of Single-shot Thoracic Paravertebral Block Combined with Intravenous Analgesia Versus Continuous Thoracic Epidural Analgesia for Chronic Pain After Thoracotomy. Pain Physician. 2021 Sep;24(6):E753-E759. PMID: 34554693.
- Zhao X, Li X, Wang Y, Xiao W, Zhang B, Meng X, et al. Efficacy of Intrathoracic Intercostal Nerve Block on Postoperative Acute and Chronic Pains of Patients Undergoing Video-Assisted Thoracoscopic Surgery. J Pain Res. 2022 Aug 6;15:2273- 2281. https://doi.org/10.2147/JPR.S369042. PMID: 35967470; PMCID: PMC9365024.
- Yu Y, Cui L, Qian L, Lei M, Bao Q, Zeng Q, et al. Efficacy of Perioperative Intercostal Analgesia via a Multimodal Analgesic Regimen for Chronic Post-Thoracotomy Pain During Postoperative Follow-Up: A Big-Data, Intelligence Platform-Based Analysis. J Pain Res. 2021 Jul 5;14:2021-2028. https://doi.org/10.2147/JPR.S303610. PMID: 34262336; PMCID: PMC8274524.
- Layera S, Bravo D, Aliste J. Bloqueos De Tronco. Rev Chil Anest 2020; 49: 65-78. https://doi.org/10.25237/revchilanestv49n01.06
- Restrepo Garcés CE, Orozco Galeano HD, Chinchilla Hermida P, Hincapié Tabares D, Echavarría Garica S, Puerta Botero JE. Bloqueo retrolaminar ecoguiado como analgesia para el manejo de neuralgia por herpes zóster: a propósito de un caso. Rev. Soc. Esp. Dolor [Internet]. 2021 Dic
- Barra C., I., & Blanch Z., A. Analgesia regional en cirugía torácica mínima invasiva. Boletín De Anestesia, (2021). (2), pp. 21–26. Recuperado a partir de https://boletinanestesia.uchile.cl/index.php/BA/article/view/64531
- Forero M, Adhikary SD, Lopez H, Tsui C, Chin KJ. The Erector Spi- nae Plane Block: A Novel Anal- gesic Technique in Thoracic Neu- ropathic Pain. Reg Anesth Pain Med. 2016 Sep-Oct;41(5):621-7. https://doi.org/10.1097/AAP.0000000000000451 PMID:27501016
- Nagaraja PS, Ragavendran S, Singh NG, Asai O, Bhavya G, Manjunath N, et al. Comparison of continuous thoracic epidural analgesia with bilateral erector spinae plane block for perioperative pain management in cardiac surgery. Ann Card Anaesth. 2018 Jul- Sep;21(3):323-327. https://doi.org/10.4103/aca.ACA_16_18. PMID: 30052229; PMCID: PMC6078032.
- Van den Broek RJC, Koopman JSHA, Postema JMC, Verberkmoes NJ, Chin KJ, Bouwman RA, et al. Continuous erector spinae plane block versus thoracic epidural analgesia in video-assisted thoracic surgery: a study protocol for a prospective randomized open label non-inferiority trial. Trials. 2021 May 4;22(1):321. https://doi.org/10.1186/s13063-021-05275-9. PMID: 33947442; PMCID: PMC8094519.
- Piraccini E, Biondi G, De Lorenzo E, Corso RM, Maitan S. Ultrasound-guided erector spinae block for post-thoracotomy pain syndrome in video-assisted thoracic surgery. Tumori. 2020 Dec;106(6):NP46-NP48. https://doi.org/10.1177/0300891620912024. Epub 2020 Mar 20. PMID: 32194005.
- Sandeep B, Huang X, Li Y, Xiong D, Zhu B, Xiao Z. A comparison of regional anesthesia techniques in patients undergoing video-assisted thoracic surgery: A network meta-analysis. Int J Surg. 2022 Sep; 105:106840. https://doi.org/10.1016/j.ijsu.2022.106840. Epub 2022 Aug 24. PMID: 36030040.
- Yao Y, Fu S, Dai S, Yun J, Zeng M, Li H, et al. Impact of ultrasound-guided erector spinae plane block on postoperative quality of recovery in video- assisted thoracic surgery: A prospective, randomized, controlled trial. J Clin Anesth. 2020;63:109783.
- Ciftci B, Ekinci M, Celik EC, Tukac IC, Bayrak Y, Atalay YO. Efficacy of an ultrasound-guided erector spinae plane block for postoperative analgesia management after video-assisted thoracic surgery: a prospective randomized study. J Cardiothorac Vasc Anesth. 2020;34(2):444–9.
- Blanco R. The ‘pecs block’: a novel technique for providing analgesia after breast surgery. Anaesthesia. 2011 Sep;66(9):847-8. https://doi.org/10.1111/j.1365-2044.2011.06838.x PMID:21831090
- Eskandr A, Mahmoud K, Kasemy Z, Mohamed K, Elhennawy T. A comparative study between ultrasound-guided thoracic paravertebral block, pectoral nerves block, and erector spinae block for pain management in cancer breast surgeries. A randomized controlled study. Rev Esp Anestesiol Reanim (Engl Ed). 2022 Dec;69(10):617-624. https://doi.org/10.1016/j.redare.2022.02.004. Epub 2022 Nov 5. PMID: 36347755.
- Jack JM, McLellan E, Versyck B, Englesakis MF, Chin KJ. The role of serratus anterior plane and pectoral nerves blocks in cardiac surgery, thoracic surgery and trauma: a qualitative systematic review. Anaesthesia. 2020 Oct;75(10):1372-1385. https://doi.org/10.1111/anae.15000. Epub 2020 Feb 16. PMID: 32062870.
- Helander EM, Webb MP, Kendrick J, Montet T, Kaye AJ, Cornett EM, et al. PECS, serratus plane, erector spinae, and paravertebral blocks: a comprehensive review. Best Practice & Research Clinical Anaesthesiology. 2019; 33: 573–581.
- Nagaraja P, Kumar K, Kalyane R, Singh N, Krishna M, Babu B, et al. Efficacy of bilateral pectoralis nerve block for ultrafast tracking and postoperative pain management in cardiac surgery. Annals of Cardiac Anaesthesia. 2018; 21: 333.
- Qiu L, Bu X, Shen J, Li M, Yang L, Xu Q, et al. Observation of the analgesic effect of superficial or deep anterior serratus plane block on patients undergoing thoracoscopic lobectomy. Medicine. 2021; 100: e24352.
- Liu X, Song T, Xu H, Chen X, Yin P, Zhang J. The serratus anterior plane block for analgesia after thoracic surgery. Medicine. 2020; 99: e20286.
- H. Ueshima and A. Kitamura, “Clinical experiences of ultrasound-guided transversus thoracic muscle plane block: a clinical experience,” Journal of Clinical Anesthesia, vol. 27, no. 5, pp. 428-429, 2015.
- Fujii S, Bairagi R, Roche M, Zhou JR. Transversus Thoracis Muscle Plane Block. Biomed Res Int. 2019 Jul 7;2019:1716365. https://doi.org/10.1155/2019/1716365. PMID: 31360703; PMCID: PMC6642770.
- Kumari P, Kumar A, Sinha C, Kumar A, Saravanan P, Smita S. Continuous bilateral transversus thoracis muscle plane block in median sternotomy. Saudi J Anaesth. 2022 Apr-Jun;16(2):255-256. https://doi.org/10.4103/sja.sja_825_21. Epub 2022 Mar 17. PMID: 35431724; PMCID: PMC9009550.
- Fujii S, Roche M, Jones PM, Vissa D, Bainbridge D, Zhou JR. Transversus thoracis muscle plane block in cardiac surgery: a pilot feasibility study. Reg Anesth Pain Med. 2019;44(5):556-560. https://doi.org/10.1136/rapm-2018-100178. Epub 2019 Mar 21. PMID: 30902911.
- Kleiman AM, Sanders DT, Nemergut EC, Huffmyer JL. Chronic Poststernotomy Pain: Incidence, Risk Factors, Treatment, Prevention, and the Anesthesiologist's Role. Reg Anesth Pain Med. 2017;42(6):698-708. https://doi.org/10.1097/AAP.0000000000000663. PMID: 28937533.
- Liang SS, Ying AJ, Affan ET, Kakala BF, Strippoli GFM, Bullingham A, et al. Continuous local anaesthetic wound infusion for postoperative pain after midline laparotomy for colorectal resection in adults. Cochrane Database of Systematic Reviews 2019, Issue 10. Art. No.: CD012310. https://doi.org/10.1002/14651858.CD012310.pub2. Accedida el 23 de enero de 2023.
- Mattila I, Pätilä T, Rautiainen P, Korpela R, Nikander S, Puntila J, et al. The effect of continuous wound infusion of ropivacaine on postoperative pain after median sternotomy and mediastinal drain in children. Paediatr Anaesth. 2016 Jul;26(7):727-33. https://doi.org/10.1111/pan.12919. Epub 2016 May 17. PMID: 27184591.
- Jang BH, So KY, Kim SH. Analgesic Effects of Continuous Wound Infusion Combined with Intravenous Patient-Controlled Analgesia for Thoracic Surgery: A Retrospective Study. Int J Environ Res Public Health. 2022 Jun 6;19(11):6920. https://doi.org/10.3390/ijerph19116920. PMID: 35682503; PMCID: PMC9180066.






